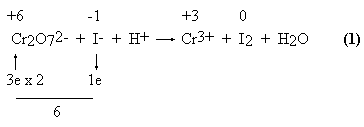
UWAGI O CHEMIKACH I RÓWNANIACH REAKCJI CHEMICZNYCH (fragmenty)
Poniższy tekst jest fragmentem większego Fopracowania dotyczącego metod dobierania współczynników w równaniach. Opracowanie to jest jednak bardzo długie, drobiazgowe, a co gorsza, ma charakter polemiczny. Trudno więc zalecić je osobom uczestniczącym w podstawowym kursie chemii. Tamto opracowanie może jednak być interesujące dla tych spośród bardziej zaawansowanych chemików, których potrafi zainteresować...
Dobieranie współczynników w równaniach reakcji jest ulubionym ćwiczeniem zadawanym przez nauczycieli chemii w szkole, a również przez wykładowców uniwersytetu. Temu tematowi poświęcana jest nieproporcjonalnie wielka część programów nauczania. Wydaje się, że można ten czas spożytkować lepiej: na wyjaśnianie istotnych praktycznych problemów chemicznych. Gorzej, że wykładowcy preferują taki sposób zapisywania równań, który nie jest właściwy z merytorycznego punktu widzenia... Jeśli doświadczonego chemika poprosić o pomoc w napisaniu nieco bardziej skomplikowanego, nietypowego równania, to z reguły próbuje on zastosować stopnie utlenienia. Po kilku bezskutecznych próbach oświadcza, że “zajmie się tym równaniem w domu”... po czym stosuje najbardziej typową dla chemików metodę: “na chybił-trafił”. Wydaje się, że postępuje tak większość nauczycieli chemii (w tym również akademickich). Ta najpopularniejsza metoda nie będzie tu omawiana. W czasopiśmie Journal of Chemical Education sformułowano wręcz kiedyś tezę, że to właśnie chemicy najczęściej zapisują równania reakcji chemicznych nieprawidłowo.
STOPNIE UTLENIENIA I BILANS ELEKTRONOWY
Stopnie utlenienia są w gruncie rzeczy przydatne jedynie do celów klasyfikacji związków nieorganicznych, oraz - w jednej z procedur wyznaczania współczynników w niektórych rodzajach równań reakcji chemicznych. Niestety, większość chemików nie wyobraża sobie chemii bez stopni utlenienia, a co gorsze, przypisuje stopniom utlenienia znaczenie, jakiego one nie mają. Są to wielkości umowne, które zależne są od sposobu ich obliczania... Atomom wodoru w cząsteczkach związków przypisuje się stopień utlenienia +1, jedynie w wodorkach metali alkalicznych wynosi on -1 (a jaki stopień utlenienia przyjąć w wodorkach pierwiastków przejściowych?). Atomom tlenu przypisuje się stopień utlenienia -2, za wyjątkiem atomów tlenu uczestniczących w wiązaniu nadtlenkowym [Dlaczego nie potraktowano w tych regułach w identyczny sposób wielosiarczków?] -O-O- (stopień utlenienia -1), ponadtlenkach np. KO2 (-1/2) oraz w fluorku tlenu F2O, gdzie wynosi on +2. Suma stopni utlenienia równa jest ładunkowi jonu (dla obojętnej cząsteczki wynosi zatem 0). Reguła ta nie sugeruje sposobu postępowania w przypadku bardziej skomplikowanych cząsteczek. Można więc przyjąć, że dopuszcza to pewną dowolność w takich przypadkach.
Opis metody należy zacząć od przytoczenia przykładu jej zastosowania. Wyznacza się wartości stopni utlenienia tych atomów, które ulegają zmianie podczas reakcji, a następnie oblicza się różnicę stopni utlenienia w wyniku reakcji. Różnica ta równa jest liczbie wymienianych elektronów. Bilanse przeprowadza się dla cząsteczek substratów w takiej postaci, w jakiej zapisane są po lewej stronie równania.
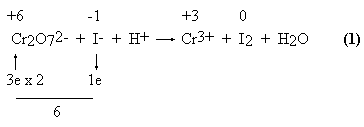
Cr2O72— + 6 I— + 14 H+ = 2 Cr3+ + 3 I2 + 7 H2O
Z bilansu elektronów wynikają współczynniki: 1 Cr2O72— oraz 6 I— . Niekiedy spotyka się zapis oddawania 2 elektronów, “ponieważ po stronie produktów jod występuje w postaci dwuatomowych cząsteczek”. Jest to błąd, ponieważ celem procedury jest wyznaczenie najpierw współczynników po lewej stronie równania. Gdyby anion jodkowy oddawał dwa elektrony, to produktem jego utlenienia byłby nie jod pierwiastkowy, ale jakiś związek jodu o stopniu utlenienia +1! Zapisanie 2e oddawanych przez anion jodkowy nie pozwoli na ostateczne zbilansowanie równania. Jeśli wyznaczone współczynniki są np. ułamkowe, to dopiero po zakończeniu procedury wyznaczania współczynników stechiometrycznych przy cząsteczkach utleniacza i reduktora można całe równanie pomnożyć przez odpowiednią liczbę (np. 2).
Poniższe przykłady są dowodem, że przypisywanie sensu fizycznego stopniom utlenienia nie tylko jest nieporozumieniem, ale jest wręcz błędem metodycznym!
zerowy stopień utlenienia
W niektórych cząsteczkach stopień utlenienia atomu wchodzącego w skład związku chemicznego i tworzącego wiązanie chemiczne z innym atomem tej cząsteczki, równy jest zero.
Dodatkowym, choć mniej istotnym problemem jest kwestia zapisu tej liczby. W zalecanej notacji rzymskiej nie ma w ogóle takiej cyfry; zero genialnie wymyślili Hindusi. Równie trudne jest zapisywanie ułamków. Stopnie utlenienia zapisywane są więc cyframi arabskimi. Powoduje to jednak wątpliwości podczas bilansowania: stopnie utlenienia mylą się z fizycznymi ładunkami jonów. W taki sposób pogłębia się tylko zamieszanie pojęciowe! Zalecenia oficjalne zdają się nie dostrzegać tych trudności.
fikcyjność i dowolność
W wielu innych cząsteczkach stopień utlenienia atomu nie ma nic wspólnego ze stanem wiązalności tego atomu:
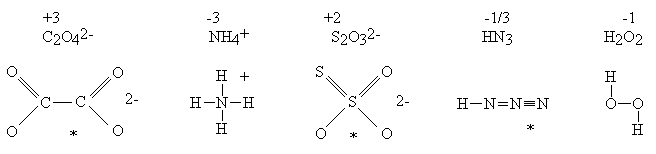
*Czytelnik proszony jest o umowne potraktowanie tych wzorów. Przedstawienie budowy podobnych cząsteczek jednym wzorem, bez wprowadzenia pojęcia mezomerii jest niemożliwe.
W anionie tiosiarczanowym istnieją dwa różnie związane atomy siarki. Stwierdzenie, że stopień utlenienia siarki wynosi +2 ma taki sam sens jak stwierdzenie, że autor tego opracowania i jego F pies mają po trzy nogi (średnio!). Wartością taką można posługiwać się tak długo, jak długo pamięta się, że nie ma ona nic wspólnego z rzeczywistością (autor nie jest mutantem, zaś pies nie jest inwalidą). Wypadałoby zatem, wprowadzając pojęcie stopnia utlenienia, uczynić takie zastrzeżenie i zadbać o to, aby zostało ono zrozumiane przez słuchaczy. Można łatwo sprawdzić, że ani autorzy podręczników, ani wykładowcy takiej uwagi nie czynią (czyżby sami nie zdają sobie z tego sprawy?). Skutkiem tego jest powszechne mylenie stopni utlenienia ze stanem wiązalności atomów. Stopnie utlenienia nazywane są czasem “pożyteczną fikcją”. Wydaje się jednak, że (tak jak każda fikcja) przynoszą one więcej szkody, niż pożytku.
Obliczanie stopni utlenienia atomów węgla w związkach organicznych prowadzi do karkołomnych rezultatów. Stopień utlenienia atomów węgla w cząsteczkach organicznych zmienia się w granicach: od –4 w CH4 do +4 w CO2. Katenacja traktowana jest jako proces utleniania-redukcji. Niekiedy dydaktycy proponują specjalne procedury dla tej klasy związków - traktując np. wiązania pomiędzy atomami węgla, jako nie istniejące. Jest to procedura sztuczna, nie mająca żadnego rozsądnego uzasadnienia, niepotrzebnie obciążająca pamięć, a w gruncie rzeczy zupełnie zbędna.
Ustalenie stopni utlenienia jest niekiedy niemożliwe bez uprzedniej znajomości faktów chemicznych. Przykład: utlenianie nadsiarczanem można opisywać dwoma sposobami
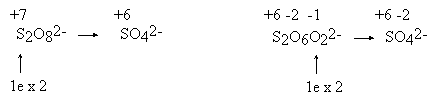
W drugim opisie traktuje się stan wiązalności (i stan utlenienia) atomów siarki u obu reagentów, jako identyczny (+6). W takim razie w anionie nadsiarczanowym istnieją dwa rodzaje atomów tlenu: jedne “zwykłe”, takie same jak w anionie SO42—, oraz inne, o stopniu utlenienia wyższym niż -2 (a więc -1). Na pierwszy rzut oka drugi opis robi wrażenie conajmniej dziwaczne, jest on jednak zgodny z naszą wiedzą chemiczną (fakt ten ma zresztą odbicie w poprawnej nazwie: dwunadtlenosiarczan). Toczenie sporu podczas wyznaczania współczynników w równaniu, o to, który z tych zapisów jest prawidłowy, jest nieporozumieniem: oba pozwalają na uzyskanie poprawnych współczynników. Naprawdę nie ma powodu, aby tolerować sensowność stopnia utlenienia siarki +2 w tiosiarczanie, a dyskryminować operowanie stopniem utlenienia +7 w nadsiarczanie! Obie te wielkości są bowiem równie fikcyjne...
Podobne problemy może sprawiać ustalenie stopni utlenienia w dwóch podobnych na pozór związkach: MnO2 i BaO2. Chemik wie, że jeden z tych związków jest zwykłym tlenkiem, a drugi nadtlenkiem. Natomiast laik, pozbawiony tej wiedzy, jest wobec tego problemu bezradny. Jeśli jednak nie przejmuje się on zbytnio problemami chemicznymi, otrzyma poprawne równanie używając obliczonych w dowolny sposób stopni utlenienia.
Kolejnym przykładem może być ustalenie stopni utlenienia atomów w anionie rodankowym. Możliwe są conajmniej dwa opisy:

Nieco dalej będziemy starali się nieco przekornie wykazać, że stopień utlenienia atomu siarki w tym anionie wynosi 0. W żadnym razie nie można wyciągnąć jednak z tego wniosku, że atom siarki w anionie rodankowym nie jest w ogóle połączony wiązaniem chemicznym z resztą anionu! Oto przykład, jak silnie zakorzenione jest mylenie stopni utlenienia ze stanem wiązalności atomów.
Należy wreszcie powiedzieć w tym miejscu, że wiele równań daje się zapisać w dwóch równoważnych formach:
IO3— + 5 I—
+ 6 H+ = 3 I2 + 3 H2O
IO3— + 5 I— + 3 H2O =
3 I2 + 6 OH—
Dodatkowy wniosek z obu zapisów jest identyczny: zajściu reakcji towarzyszy wzrost pH. Rozstrzygnięcie który z nich jest poprawny, jest możliwe jedynie na drodze doświadczalnej. Z punktu widzenia formalnego oraz stechiometrii chemicznej, oba zapisy są równocenne. Należy więc zaapelować do egzaminatorów o wyrozumiałość w ocenie takich zapisów przez nie mających doświadczenia praktycznego Studentów.
W praktyce dydaktycznej spotykamy się czasem z zapisem, który dla początkującego słuchacza jest zupełnie niejasny, np. zapis równania utleniania nadmanganianem w środowisku kwaśnym:
Mn (VII) + 5e ® Mn (II)
Reasumując: stosowanie stopni utlenienia pozwala na wyznaczanie współczynników w równaniach reakcji tylko niektórych rodzajów (utleniania-redukcji), opiera się na fikcyjnych wielkościach, które powodują pojęciowe zamieszanie, zaś w niektórych przypadkach ustalenie i zastosowanie stopni utlenienia jest bardzo kłopotliwe. Działając w stanie rozpaczy zaproponowałem kiedyś wręcz krótkie westchnienie przed przystąpieniem do obliczania stopni utlenienia: "Aniele Stróżu mój, chroń mnie przed diabelską pokusą przypisywania stopniom utlenienia jakiegokolwiek realnego sensu chemicznego". (Oraz przed kontaktem z egzaminatorem, który tego oczywistego faktu nie przyjmuje do wiadomości...)
RÓWNANIA POŁÓWKOWE
Równania połówkowe polegają na rozłożeniu reakcji redoks na dwa [a właściwie skąd wiadomo, że w sumarycznej, złożonej reakcji redoks nie może brać udziału więcej procesów cząstkowych? Takie założenie ogranicza przecież liczbę rozwiązań. Nieco dalej opisane będą interesujące przykłady takich reakcji.] procesy cząstkowe, w których pojawiają się wolne elektrony. Zbilansowanie polega na takim dobraniu współczynników, aby liczba elektronów oddawanych w jednej reakcji połówkowej była równa liczbie elektronów przyjmowanych w drugiej z reakcji połówkowych.
Z naciskiem należy podkreślić, że zapis równań połówkowych ma pozwalać na ominięcie niejednoznaczności związanych z pojęciem stopnia utlenienia. Nagminnym błędem dydaktycznym jest więc wyznaczanie współczynników w równaniu połówkowym właśnie w oparciu o stopnie utlenienia. Celem zapisywania równania połówkowego jest bowiem wyznaczenie liczby wymienianych elektronów. Dokonuje się tego w wyniku prostych rachunków bilansu atomów poszczególnych rodzajów po obu stronach równania, ewentualnym uzupełnieniu brakujących typowych elementów (H+, H2O, OH—) i dokonaniu bilansu fizycznych ładunków jonów (a nie: abstrakcyjnych stopni utlenienia!), a na koniec wyznaczeniu brakujących po jednej ze stron równania liczby elektronów, czyli brakujących ładunków ujemnych. Żelazną zasadą jest: rozpocząć od napisania dwóch reagentów; nie dopisywać żadnego kolejnego reagenta - dopóki nie zbilansowano tych zapisanych wcześniej rodzajów atomów, które są możliwe do zbilansowania. Inne postępowanie utrudnia niepotrzebnie racjonalną sekwencję. Kolejne etapy są następujące:...
| bilans atomów Cr: | ..... | Cr2O72— ® 2 Cr3+ |
| bilans atomów O: | ... | Cr2O72— ® 2 Cr3+ + 7 H2O |
| bilans atomów H: | ... | Cr2O72— + 14 H+ ® 2 Cr3+ + 7 H2O ...(po lewej stronie jest nadmiar 6 ładunków “+”) |
| bilans ładunków jonów: | ... | Cr2O72— + 14 H+ + 6e ® 2 Cr3+ + 7 H2O....(bo po lewej stronie był nadmiar 6 ładunków “+”) |
Z reguły, jako drugi rodzaj atomów bilansuje się atomy tlenu (bo oprócz substratu, jedynym związkiem zawierającym tlen - jest woda), a następnie dopiero atomy wodoru (wodór zawarty jest zarówno w postaci cząsteczek wody, jak i posiadających ładunek - kationów wodorowych). Błędem jest wpisywanie od razu więcej niż dwóch reagentów; powoduje to tylko dezorientację co do kolejności kolejnych kroków procedury...
Okazuje się, że do zapisania tego równania nie trzeba było stosować stopni utlenienia, ani też znać właściwości substancji. Właściwości utleniające (a nie: redukujące) dwuchromianu wynikają niejako automatycznie z przeprowadzonych rachunków. Jest to wniosek bulwersujący, ponieważ jedynymi przesłankami do jego uzyskania był wzór (skład) substratu i produktu. Czyżby więc to, że jakaś substancja jest utleniaczem (konsumentem elektronów), wynikało tylko ze stosunków liczbowych określających wzór związków? Jakże tak? A gdzie stopnie utlenienia, Układ Okresowy, pojęcie elektroujemności, równanie Schrödingera i pozostała wiedza chemiczna? Takie twierdzenie graniczy o krok z kabalistyką... Nieco później posuniemy się w podobnym rozumowaniu jeszcze dalej!
Wielu dydaktyków nie może zrozumieć, dlaczego przy zapisywaniu równań połówkowych nie należy stosować stopni utlenienia; przecież rezultat jest taki sam... A chodzi o to, aby przyswoić sobie metodę, która będzie skuteczna nawet wtedy, gdy będą istniały kłopoty z obliczaniem stopni utlenienia, nie mówiąc już o równaniach reakcji nie będących reakcjami redoks. W tym opracowaniu podaję wiele takich przykładów. A wreszcie: proponowana procedura jest o wiele prostsza, gdyż w ogóle nie wymaga stosowania stopni utlenienia, a nawet znajomości właściwości chemicznych substancji. Ostatecznym kontrargumentem, który często słyszę na zakończenie, jest: "tak nas uczono i tak jesteśmy przyzwyczajeni". W tym momencie prowadzenie dalszej dyskusji staje się bezcelowe...
Wielu chemików lubi posługiwać się równaniami połówkowymi uważając, że odzwierciedlają one “rzeczywistą naturę” procesów chemicznych - w odróżnieniu od sumarycznych równań reakcji. Niestety, jest to przekonanie błędne. Jeśli w równaniu połówkowym bierze udział więcej cząstek substratów niż dwie (a tak jest najczęściej), to z pewnością równanie takie jest sumą kilku procesów elementarnych. Należy pamiętać, że w całej chemii nie jest znana ani jedna reakcja, której mechanizm jest więcej, niż dwucząsteczkowy! (niezależnie od postaci równania ogólnego). Również opieranie zapisu równania Nernsta na równaniach połówkowych może być zawodne... Doświadczalne zależności polarograficzne mogą być również sprzeczne z równaniami połówkowymi redoks.
Na razie Czytelnik proszony jest o algebraiczne udowodnienie w opisany sposób (bez posługiwania się stopniami utlenienia!), że procesy:
Cr2O72— ® CrO42— .........oraz: .........AsO2— ® AsO33—
nie są reakcjami połówkowymi utlenienia-redukcji.
równania połówkowe: utlenianie (?) winianów nadtlenkiem wodoru, krok po kroku:
C4H4O62−
→ 4 CO2
C4H4O62−
+ 2 H2O
→ 4 CO2
bilans atomów tlenu, a nie wodoru
C4H4O62−
+ 2 H2O
→ 4 CO2
+ 8 H+ teraz bilans wodoru
C4H4O62−
+ 2 H2O
= 4 CO2
+ 8 H+ + 10 e¯ z bilansu ładunków; winian jest tu
reduktorem (obyło się bez stopni utleniania…) (1)
H2O2
→ 2 H2O
z bilansu atomów tlenu, a nie wodoru
H2O2
+ 2 H+ → 2 H2O
teraz bilans wodoru
H2O2
+ 2 H+ + 2 e¯ → 2 H2O z bilansu ładunków;
nadtlenek wodoru jest tu utleniaczem (2)
po zsumowaniu równania (1) i pięciokrotnego równania (2) otrzymuje się równanie sumaryczne, automatycznie ujawniona zostaje rola obu reagentów, wszystko bez użycia stopni utlenienia
równania redoks w środowisku zasadowym
Czasami w równaniu reakcji, zamiast układu reagentów: H+/H2O, powinna wystąpić para substancji: H2O/OH—. Stwarza to niekiedy problemy rachunkowe, gdyż w tym przypadku oba reagenty (H2O i OH—) zawierają zarówno atomy tlenu, jak i wodoru. Jest to skomplikowane ze względu na konieczność równoczesnego bilansowania w pamięci dwóch rodzajów atomów: tlenu i wodoru. Najprostsze jest zapisanie równania z udziałem jonów wodorowych, a następnie dodanie odpowiedniej liczby anionów OH— do obu stron tego równania. Po uwzględnieniu syntezy cząsteczek wody i usunięciu ich z obu stron równania, uzyskuje się alternatywny zapis z anionami OH— zamiast kationów wodorowych.
NO3− +
9 H+ + 8 e = NH3 + 3 H2O
NO3−
+ 9 H+ +
9 OH− + 8 e = NH3
+ 3 H2O + 9 OH−
NO3−
+ 9 H2O + 8 e = NH3 + 3 H2O
+ 9 OH−
NO3−
+ 6 H2O + 8 e = NH3 +
9 OH−
utlenianie rodanków:
Problemem sygnalizowanym uprzednio było ustalenie stopni utlenienia atomów (szczególnie atomu siarki) w anionie rodankowym. Pewne wskazówki może dać analiza równania reakcji utleniania rodanków:
SCN— ® SO42— + CN—
Zapis równania połówkowego pozwala na wyznaczenie liczby wymienianych elektronów:
SCN— + 4 H2O ® SO42— + CN— + 8 H+ + 6e
Niesposób nie zauważyć formalnej analogii z zapisem utleniania pierwiastkowej siarki:
S + 4 H2O ® SO42— + 8 H+ + 6e
Czyżby zatem można przyjąć, że stopień utlenienia siarki w rodankach jest taki sam, jak w siarce pierwiastkowej - czyli zero?
Jak zatem, po tylu krytycznych uwagach, powinni chemicy zapisywać równania reakcji? Jeśli fikcja stopni utlenienia prowadzi do poprawnych rezultatów, to czy w ogóle ma sens posługiwanie się nią? Czy nie lepiej korzystać z bardziej pierwotnych przesłanek? Ponieważ stopnie utlenienia oblicza się (niestety, czasem w dowolny sposób) na podstawie składu (wzoru) cząsteczek, zatem taką pierwotną wielkością powinien być skład (wzór) cząsteczki. Na tym opiera się procedura algebraiczna, najbardziej ogólna metoda, abstrahująca od jakichkolwiek przesłanek chemicznych (poza wzorami substancji), dająca jednak zaskakujące wnioski natury chemicznej, a pozwalająca dodatkowo na wykrywanie popełnianych błędów.
PROCEDURA ALGEBRAICZNA
Niżej zostaną przedstawione zasady tej procedury, a następnie przykłady rodzajów rozwiązań. Czytelnik proszony jest teraz o tymczasowe usunięcie z pamięci takich przesłanek chemicznych, jak: stopnie utlenienia, pojęć utleniacza i utleniania, reduktora i redukcji, bilansu elektronów, reguł dotyczących uwzględniania substancji dodatkowych takich jak woda, jony wodorowe, oraz zapisywania substratów po lewej, a produktów po prawej stronie równania. Już w tym miejscu należy zwrócić uwagę, że jest to więc najbardziej uniwersalny z opisywanych sposobów zapisywania równań chemicznych. W tej procedurze identycznie traktowane są zarówno reakcje będące, jak i nie będące reakcjami redoks, reakcje połówkowe, a wreszcie reakcje związków organicznych. Aby opis uczynić bardziej interesującym, w wielu przykładach celowo popełniane będą błędy oczywiste dla doświadczonego chemika, a sprawiające trudność laikowi. Jeśli procedurę algebraiczną potraktować jako formę dialogu, to wypada stwierdzić, że jest to metoda całkowicie odporna zarówno na niezamierzone błędy, jak i celowe próby oszustwa (!). Fascynujący jest sposób, w jaki uzyskuje się informacje o popełnionych błędach lub zaskakujące wskazówki o czysto chemicznym charakterze. Dialog prowadzony będzie w języku algebry elementarnej.
Wzory substratów i produktów zapisuje się po obu stronach równania. Kolejnym reagentom przypisuje się współczynniki: a, b, c, d itd. Układa się następnie równania bilansowe dla wszystkich rodzajów atomów biorących udział w reakcji, oraz dla ładunków jonów reagentów. Po rozwiązaniu tego układu równań otrzymuje się konkretne wartości współczynników stechiometrycznych. Tak jak zawsze w algebrze, możliwe są trzy grupy rozwiązań: brak rozwiązań, jedno rozwiązanie oraz nieskończenie wielka liczba rozwiązań takiego układu równań.
Brak rozwiązań
rozkład kwasu siarkowego na SO2:
a H2SO4 ® b H2O + c SO2
| bilans atomów H: | .... | 2a = 2b |
| bilans atomów S: | .... | a = c |
| bilans atomów O: | .... | 4a = b + 2c |
Rozwiązując układ równań otrzymujemy: ....a = 0, ......b = 0, ......c = 0.
Tłumacząc wynik algebraiczny na język chemiczny oznacza to, że taka reakcja zachodzi wtedy, kiedy nie biorą w niej udziału żadne reagenty! Przyczyna jest oczywista dla każdego chemika: popełniono błąd, ponieważ produktem odwodnienia kwasu siarkowego nie jest SO2, ale SO3, lub mieszanina SO2 i tlenu! Laik, popełniwszy taki błąd, mógłby jednak długo i bezskutecznie męczyć się przy stosowaniu typowo chemicznej procedury ustalania współczynników.
Ponieważ rozwiązywanie układu równań jest tym łatwiejsze, im mniej jest niewiadomych, zatem w typowej procedurze algebraicznej przyjmuje się arbitralnie jeden współczynnik (zazwyczaj przy reagencie o najbardziej skomplikowanej budowie), jako równy np. 1 (równie dobrze: 2, 3 lub 17), a współczynniki przy kolejnych reagentach staramy się wyrażać za pomocą parametrów już wprowadzonych - tam, gdzie jest to zupełnie oczywiste. Wstawienie w poprzednim równaniu współczynnika 1 w miejsce parametru “a”, trzeba uznać za próbę “oszukania” procedury. Interesujące, czy istotnie w taki sposób można będzie uzyskać wynik inny od poprzedniego rezultatu?
1 H2SO4 ® b H2O + c SO2
| bilans atomów H: | .. . | 2 = 2b |
| bilans atomów S: | .... | 1 = c |
| bilans atomów O: | .... | 4 = b + 2c |
Ten układ równań jest układem sprzecznym i nie ma rozwiązań.
Wniosek z obu przykładów: taka reakcja jest niemożliwa. Albo nie powstaje SO2, albo pominięto jeden z produktów. Procedura algebraiczna okazuje się rzeczywiście odporna na tego rodzaju błędy lub manipulacje... Należy pamiętać, że otrzymane rozwiązania muszą spełniać wszystkie równania bilansowe.
W procedurze algebraicznej można omyłkowo dowolnie zamienić stronami substraty i produkty reakcji. Również zapisanie “środowiska” po niewłaściwej stronie nie stanowi żadnego problemu. Obliczone współczynniki w takich przypadkach będą miały wartość ujemną.
Jedno rozwiązanie
Prawie wszystkie przypadki prawidłowo zapisanych równań reakcji chemicznych dają w wyniku jeden zespół konkretnych rozwiązań: dodatnich, ujemnych lub ułamkowych. Niektóre parametry mogą być równe zero.
równanie reakcji azotanów z udziałem anionów glinianowych oraz glinu:
NO3— + a AlO2— + b H2O ® NH3 + a Al + c OH—
| bilans atomów O: | .... | 3 + 2a + b = c |
| bilans atomów H: | ... | 2b = 3 + c |
| bilans ładunków: | ... | - 1 - a = - c |
bilanse atomów N i Al są tautologiami typu: ....1 = 1
Rozwiązanie: ....a = -8/3, ......b = 2/3, ......c = -5/3.
Aniony azotanowe reagują z metalicznym glinem, a nie z anionami glinianowymi! AlO2— jest jednym z produktów reakcji, natomiast jony OH— są substratem, a nie produktem.
3 NO3— + 8 Al + 2 H2O + 5 OH— = 3 NH3 + 8 AlO2—
Zamiast współczynnika c, w celu ograniczenia liczby zmiennych i uproszczenia obliczeń można wstawić wartość: (1+a), która wynika z bilansu ładunków. Procedura ta dałaby identyczny wynik.
w postaci “kanonicznej”:
NO3— + a NH3 + b Al + c AlO33— + d H2O + e OH— = 0 .... ....(2)
| bilans atomów N: | .... | 1 + a = 0 |
| bilans atomów O: | .... | 3 + 3c + d + e = 0 |
| bilans atomów H: | .... | 3a + 2d + e = 0 |
| bilans atomów Al: | b + c = 0 | |
| bilans ładunków: | .... | -1 - 3c - e = 0 |
Rozwiązanie: ....a = -1, ......b = 8/3, ......c = -8/3, ......d = -2, ......e = 7.
3 NO3— + 8 Al + 21 OH— = 3 NH3 + 8 AlO33— + 6 H2O
Równanie (2) Czytelnik może uprościć, bowiem współczynnik przy NH3 jest liczbowo równy współczynnikowi przy NO3—, ale musi mieć przeciwny znak, gdyż te dwie substancje muszą występować po dwóch różnych stronach równania. Podobnie jak metaliczny glin i anion ortoglinianowy.
NO3— - NH3 + b Al - b AlO33— + d H2O + e OH— = 0
Zachęcam Czytelnika do próby “oszukania” procedury poprzez wstawienie współczynników: ......-b Al oraz ......+b AlO33—. Rezultat takiej próby nie jest przypadkowy i powinien dawać do myślenia...
sumaryczne czy połówkowe?
Również zapisywanie równań połówkowych odbywa się identycznie:
AsO2— + x H2O ® AsO33— + 2x H+ + y e
x = 1, ......y = 0
To równanie nie jest więc równaniem reakcji połówkowej redoks (y = 0).
Natomiast zapisanie równania sumarycznego redoks jako równania połówkowego (z elektronami) prowadzi do nieskończonej liczby rozwiązań. Zostaje ono potraktowane jako suma dwóch równań połówkowych, które nie są zbilansowane. Takich kombinacji niezbilansowanych sum dwóch równań połówkowych jest nieskończenie wiele, w odróżnieniu od jednej tylko sumy równań połówkowych, zbilansowanej pod względem liczby wymienianych elektronów.
Cr2O72— + x I— + y H+ ® 2 Cr3+ + x/2 I2 + y/2 H2O + z e
W procedurze algebraicznej zapisywanie równań reakcji związków organicznych nie różni się niczym od innych reakcji:
równanie połówkowe reakcji utleniania winianów:
C4H4O62— + a H+ ® 4 CO2 + b H2O + c e
| bilans atomów O: | .... | 6 = 8 + b; ......b = -2 |
| bilans atomów H: | .... | 4 + a = 2b; ......a = -8 |
| bilans ładunków: | .... | - 2 + a = - c; ......c = 10 |
C4H4O62— + 2 H2O = 4 CO2 + 8 H+ + 10 e
Zbędne jest więc zastanawianie się nad stopniami utlenienia węgla w winianie.
Nieskończenie wiele rozwiązań
Skuteczność metody algebraicznej wypadałoby określić jako przekraczającą 100 %. Nie tylko bowiem daje się w ten sposób zapisać wszystkie równania reakcji chemicznych, ale metoda pozwala na korygowanie popełnianych błędów. Dodatkowo niekiedy okazuje się, że pod “niewinnie” wyglądającym równaniem kryje się zaskakująco skomplikowany proces, czego nie podejrzewają nawet doświadczeni chemicy... I wszystko to daje się ustalić po prostu na papierze, bez przeprowadzania odpowiednich eksperymentów!
Przy próbie zastosowania proponowanej procedury algebraicznej uzyskuje się czasem układ równań bilansowych mniej liczny niż liczba niewiadomych współczynników. W konsekwencji układ taki ma nieskończenie wiele rozwiązań. Jest to najbardziej interesujący chemicznie przypadek, zazwyczaj będący zaskoczeniem dla chemika. Otrzymanie takiego wyniku jest wskazówką, że reakcja chemiczna złożona jest z sumy conajmniej dwóch niezależnych, biegnących równolegle procesów. Jest interesujące, że do takiego wniosku można dojść bez przesłanek i intuicji chemicznej. Paradoksalnie, stosując klasyczną procedurę chemiczną, można łatwo przeoczyć grupy rozwiązań mające zupełnie określony sens chemiczny. Metoda algebraiczna jest jedynym sposobem (poza doświadczeniem) wykrycia nieoczekiwanie skomplikowanego przebiegu niektórych pozornie prostych i znanych reakcji chemicznych. Dla większości doświadczonych chemików złożony charakter opisywanych procesów stanie się oczywisty po zakończeniu procedury algebraicznej. A ilu z nich domyśli się tego już przy zapisywaniu początkowego równania?
reakcja arseninów z dwuchromianami:
AsO2— + x Cr2O72— + 2y H+ ® AsO33— + 2x CrO42— + y H2O
| bilans atomów O: | .... | 2 + 7x = 3 + 8x + y ......y = -1- x |
| bilans ładunków: | .... | 1 -2x + 2y = -3 -4x ......2y = -2-2x |
bilanse atomów H, As oraz Cr są tautologiami typu: .....1 = 1
Oba równania bilansowe okazują się identyczne. Jest to więc układ jednego równania z dwiema niewiadomymi. Można to równanie uporządkować przez wprowadzenie jednego tylko parametru:
AsO2— + x Cr2O72— + (1+x) H2O = AsO33— + 2x CrO42— + 2(1+x) H+
Równanie to jest spełnione dla każdej wartości x. Mniej uważny Czytelnik, który zafascynowany algebrą zbyt dosłownie potraktował polecenie zapomnienia o faktach chemicznych, być może dotąd nie spostrzegł, że cały proces w gruncie rzeczy nie ma sensu. Jest bowiem sumą dwóch niezależnych reakcji (związanych jedynie wspólnym udziałem wody i jonów wodorowych), z których żadna nie jest reakcją utlenienia-redukcji! Nawet jednak laik uzyskuje w tym momencie wskazówkę o złożonym charakterze procesu. Podstawiając: x = 0 (czyli dla reakcji bez udziału związków chromu), a następnie: x ® Ą (czyli dla reakcji bez udziału związków arsenu), można bez trudu zidentyfikować oba procesy składowe. Były one zresztą sygnalizowane już w tym opracowaniu. Czyżby Czytelnik dał się nabrać na taki żart? A jeśli tak, to metoda algebraiczna okazała się jednak lepsza...
reakcja nadmanganianu i nadtlenku wodoru:
Aby móc łatwiej porównać wynik z typowym zapisem podręcznikowym, przyjęto arbitralnie współczynnik 2 MnO4—.
2 MnO4— + x H2O2 + y H+ ® 2 Mn2+ + w H2O + z O2
| bilans atomów O: | .... | 8 + 2x = w + 2z |
| bilans atomów H: | .... | 2x + y = 2w |
| bilans ładunków: | .... | -2 + y = 4 |
| bilans atomów Mn: | .... | tautologia typu: ...1 = 1 |
Rozwiązanie: ....y = 6, ......w = x+3, ......z = x/2+2,5
2 MnO4— + x H2O2 + 6 H+ ® 2 Mn2+ + (x+3) H2O + (x/2+2,5) O2
Można sprawdzić, że równanie to jest spełnione i ma ono sens algebraiczny dla każdej wartości “x”, np:
Czytelnik może spróbować również
zinterpretować wyniki otrzymane dla ułamkowych i ujemnych wartości parametru “x”.
Procedura taka nie jest jedynie algebraiczną ciekawostką, gdyż niektóre z
rozwiązań mają również bardzo konkretny sens chemiczny.
Dla ..x
= 0 jest to reakcja rozkładu KMnO4
na tlen, która może zachodzić w bardzo stężonym, silnie zakwaszonym roztworze.
Dla ..x
= 5 jest to “klasyczna” reakcja zachodząca podczas miareczkowania nadtlenku
wodoru nadmanganianem. Dla...x
®
Ą
...otrzymuje
się reakcję rozkładu nadtlenku wodoru.
Reakcja MnO4— + H2O2
jest właśnie przykładem tzw. “niestechiometrycznej”
reakcji chemicznej.
Warto zwrócić uwagę, że w warunkach
w których x = 5, z jednego mola H2O2
otrzymuje się jeden mol gazowego tlenu, natomiast przy
....x
®
Ą
, z jednego mola H2O2
uzyskuje się zaledwie
połowę tej ilości tlenu.W rzeczywistości stanowi ona sumę conajmniej dwóch
niezależnych reakcji zachodzących jednocześnie. Są to przede wszystkim:
utlenianie H2O2 nadmanganianem (x
= 5), oraz katalityczny rozkład H2O2
(x ®
Ą
): ......2
H2O2 ®
2 H2O + O2.
Ta ostatnia reakcja zachodzi w miejscach słabiej zakwaszonych, w których czasowo
powstają pośrednie produkty redukcji nadmanganianu, będące katalizatorami
rozkładu nadtlenku wodoru. Powszechnie, choć zasadniczo bezzasadnie przyjmuje
się, że obie te substancje reagują w stosunku 2 mole MnO4—
+ 5 moli H2O2.
Dzieje się tak jedynie przy silnie zakwaszonym roztworze i
powolnym wkraplaniu z jednoczesnym mieszaniem roztworu (x
= 5). Ilość tlenu powstająca w reakcji H2O2
z nadmiarem nadmanganianu przy braku mieszania, jest zawsze mniejsza
od ilości wynikającej z takiej stechiometrii i różnica ta zależy dodatkowo od:
stopnia zakwaszenia, kolejności dozowania i sposobu mieszania. Przy wkraplaniu
nadmanganianu do nadtlenku wodoru otrzymuje się mniej tlenu, niż przy odwróceniu
kolejności! Fakt ten jest szokujący dla chemika, natomiast laik stosujący
procedurę algebraiczną
przyjmie to bez zdziwienia. Doświadczalne stwierdzenie tych różnic jest dość
kłopotliwe, chociaż ustalenie warunków, w których reakcja ta zachodzi
praktycznie
według stechiometrii “2+5”, było przedmiotem badań.
reakcja formaldehydu z nadtlenkiem wodoru:
Bardzo interesujący jest przebieg reakcji stosowanej do miareczkowego oznaczania formaldehydu w roztworze. Po zaalkalizowaniu próbki znanym nadmiarem NaOH, dodaje się nadmiar H2O2. Formaldehyd przekształca się w kwaśny produkt (HCOOH), a pozostały NaOH odmiareczkowuje się mianowanym roztworem HCl. Zupełną niespodzianką jest jednak rzeczywisty przebieg tego procesu: podczas burzliwej reakcji wydzielają się bowiem znaczne ilości gazowego wodoru!
Ciekawe, czy znajdzie się jakiś Czytelnik, który potrafi w tym momencie zapisać metodycznie poprawnie równanie tej reakcji oraz odpowiedzieć, skąd pochodzi gazowy wodór? Klasyczny sposób wyznaczenia współczynników w tym równaniu zupełnie zawodzi.
CH2O + x H2O2 + y OH— ® HCOO— + w H2 + z H2O [???]
krok dalej: rachunek macierzowy
Rozwiązywanie układów równań z więcej niż trzema niewiadomymi jest ogromnie uciążliwe. Przykładem może być cytowane wcześniej równanie Blakleya. Zastosowanie rachunku macierzowego bardzo ułatwia to zadanie (przynajmniej formalnie). Rachunek macierzowy pozwala na zbudowanie odpowiednich programów komputerowych, zastosowanie rachunku macierzowego rozszerza prócz tego jakościowo zakres stosowalności metody algebraicznej. Program komputerowy dostępny jest na stronie internetowej “Chemfan”: http://pc69.wbc.lublin.pl/ChemFan/Oprogramowanie/ . Inny, jeszcze bardziej interesujący program wraz z instrukcją nadesłał jeden z Czytelników (Piotr Kosztołowicz). Wreszcie kolejny program opracował Witold Mozga. Program podaje słowny komentarz w przypadkach błędów oraz nieskończonej liczby rozwiązań. Zachęcam do "poznęcania się" nad nimi (programami!), zadając im do rozwiązania którąś z reakcji "niestechiometrycznych". Wynikiem są przypadkowe dość dwa równania spośród nieskończenie wielu. Zmiana kolejności wpisywania reagentów daje inne, ale także tylko dwa rozwiązania.
Podsumowanie
Powyżej opisane rozważania dotyczą jedynie formalnego zapisu równań reakcji chemicznych. Nie rozważano więc w ogóle problemu termodynamicznej możliwości ich zachodzenia.
Chemicy przy zapisywaniu typowych równań utleniania-redukcji będą w dalszym ciągu stosować bilanse elektronowe w oparciu o stopnie utlenienia. Jest to procedura, która jest skuteczna w większości przypadków. Chemikom trudno wyobrazić sobie chemię bez stopni utlenienia. Podświadomie uważają stopnie utlenienia za klucz do zrozumieniu chemii i trudno będzie im zaakceptować fakt, że można się bez stopni utlenienia doskonale obejść. Byłoby dobrze, aby chemicy zdawali sobie sprawę z nieścisłości związanych z tym pojęciem oraz pojęciowymi błędami z nim związanymi. I uświadamiali te problemy swoim Słuchaczom...
Równania połówkowe powinny być rozwiązywane bez wprowadzania stopni utlenienia. Nie powinny być prócz tego mylone z równaniami elementarnymi mechanizmów reakcji.
Warto pamiętać, że istnieją skuteczne metody mnemotechniczne uzupełniania równań. To, że nie mają one nic wspólnego z przesłankami chemicznymi jest ich zaletą, a nie wadą.
Chemicy nie będą chętnie posługiwać się procedurą algebraiczną, która jest po prostu dosyć żmudna. Prócz tego nie do przyjęcia emocjonalnego dla chemików jest fakt, że właśnie taka procedura ma największy zakres stosowalności, a prócz tego dostarcza informacji będących czasem zaskoczeniem dla dydaktyków z długoletnim stażem. Warto jednak tę procedurę zastosować wszędzie tam, gdzie zawodzą inne sposoby...
Na rozwiązanie czeka ciągle problem precyzyjnego zdefiniowania reakcji utlenienia-redukcji.
Tomasz Pluciński
nowy adres:
tomasz.plucinski@ug.edu.pl
| F | strona główna |