SKAKANIE PRZEZ POPRZECZKĘ CZYLI ENERGIA AKTYWACJI (PIERWSZY
MECHANIZM DZIAŁANIA KATALIZATORA).
** ostatnia aktualizacja 9.06.2005 **
Czasem słyszy się nieprawdziwą opinię, że Fsamorzutne są tylko te reakcje chemiczne, które są procesami egzotermicznymi. Im silniej egzotermiczna jest reakcja, tym (rzekomo) szybciej ona zachodzi...
Jak więc wytłumaczyć fakt, że mieszanina wodoru i tlenu jest w zwykłych warunkach zupełnie stabilna? Synteza wody jest procesem tak powolnym, że w temperaturze pokojowej jej czas połówkowy oceniany jest na miliardy lat! A przecież reakcja syntezy wody jest jednym z najbardziej egzotermicznych procesów chemicznych... Tak więc szybkość reakcji chemicznej nie zależy od efektu energetycznego netto. Co decyduje, że jedne reakcje chemiczne są szybkie, a inne - powolne?
po pierwsze: zaciekawić (lub chociaż rozbudzić)...
Z reguły wykład o katalizie zaczynam od doświadczenia. Przygotowuję do tego ok. 250 ml mieszaniny wodoru z tlenem (najwygodniej sporządzić ją elektrolitycznie: odwrócony korpus strzykawki 20 ml, korek gumowy z dwoma gwoździami, roztwór NaOH, zasilacz do ładowania komórki) w odwróconym przezroczystym kubeczku plastikowym po wodzie sodowej. Już teraz zadaję audytorium postawione wyżej pytanie. Na końcu aluminiowego zgiętego drucika umieszczam wcześniej mały zwitek waty, na który nasypuję ok. 50 mg katalizatora: 10-procentowego palladu na węglu aktywnym. Czasami zalecam audytorium uważne wpatrywanie się w katalizator, aby ew. zobaczyć powstawanie kropelek wody, lub uważne nasłuchiwanie szelestu kapiących kropel... Po podkreśleniu, że reakcja będzie przebiegać na zimno (bez podpalania), nakładam kubeczek z gazami na katalizator... (Przedtem wkładam do uszu kawałki waty; można obłudnie wyjaśnić, że to dlatego, aby nie nasypał się węgiel do ucha!). Po 1-2 sekundach z kubka pozostają tylko fruwające w powietrzu strzępy...

dygresja: Kiedyś próbowałem wykonać eksperyment inaczej: odwrócony kubeczek z mieszaniną gazów umocowany był w łapie statywu, a watkę z katalizatora wsunąłem do niego od dołu. I nic... Wybuch następuje zwykle po 1-2 sekundowym opóźnieniu niezbędnym do rozgrzania katalizatora i przeniesieniu reakcji na całą objętość naczynia. Trzymana w ręku watka nie była zupełnie nieruchoma i jej poruszanie chłodziło skutecznie katalizator. Gazowy wodór jest niezmiernie skutecznym chłodziwem z powodu wielkiej szybkości lekkich cząsteczek wodoru i bardzo małej lepkości (tu kolejna dygresja: to właśnie te cechy są powodem, że gwizdek zasilany wodorem wydaje dźwięk o wiele wyższy, niż przy dmuchaniu powietrzem). Doskonałe przewodnictwo cieplne wodoru ma zastosowanie np. w detektorach (katarometrach) w chromatografii gazowej. Gazowy wodór stosowany jest też jako chłodziwo w blokach generatorów w elektrowniach. Jest to chłodziwo tak skuteczne, że stosuje się je pomimo konieczności kłopotliwego utrzymania i kontroli szczelności płaszcza obudowy takiego urządzenia - i zagrożenia wybuchowego. Tak więc ten nieudany eksperyment jest udaną ilustracją kolejnej istotnej cechy fizykochemicznej
test sportowy
Na razie proponuję rozstrzygnięcie następującego, pozornie nie-chemicznego problemu. Organizujemy test sportowy polegający na tym, że wybraną grupę ludzi zachęcamy do przeskoczenia ponad poprzeczką ustawioną na pewnej wysokości. Jaka część badanego zbiorowiska jest w stanie przeskoczyć ponad poprzeczką? Od czego zależy wartość liczbowa tego ułamka? Co należy zrobić, aby wzrósł procent pozytywnych rezultatów?
Wpływ na to mają dwa czynniki. Wynik zależy oczywiście od tego, jakie jest to zbiorowisko (inaczej będzie np. dla emerytów, a inaczej dla zgrupowania sportowców). Zależy również od wysokości na której ustawiona jest poprzeczka. Jeśli dążymy do tego, aby wzrósł procent udanych prób, to można zastosować środki dopingujące skaczących #. Innym sposobem jest po prostu obniżenie poprzeczki ## (niektórzy zapewne będą próbowali, korzystając z chwili nieuwagi, przejść pod poprzeczką...).
# w sporcie tzw. "amatorskim" jest to doping finansowy lub farmakologiczny, a w wojsku - groźba represji w postaci karnej musztry w błocie.
## w podobny sposób traktowana jest dydaktyka; sugerują to coraz częściej Dziekani na tzw. "wyższych" studiach. Praktyka obniżania "poprzeczki intelektualnej" stosowana jest od dawna przez władze TVP w postaci nie kończących się, ogłupiających widzów konkursów, żenujących programów typu "Big Brother" oraz programów nie wiedzieć czemu nazywanych "rozrywkowymi" - w rodzaju "Śmiechu warte"...
Inny przykład pochodzi z turystyki. Jeśli zamierzamy przejść trasą od Pięciu Stawów Polskich (1668 m. npm.) do Morskiego Oka (1393 m. npm.), to możemy wybrać drogę (niezmiernie zresztą malowniczą) przez FSzpiglasową Przełęcz (2114 m. npm.), http://www.youtube.com/watch?v=ZHxvbZdI6r8&feature=related lub wybrać łatwiejszą drogę trawersem Świstówki Roztockiej (ok. 1800 m. npm.). Oczywiście, znacznie więcej leniwych turystów wybiera tę ostatnią drogę - wymagającą mniejszego wysiłku. Można sobie wyobrazić jeszcze łatwiejsze rozwiązanie, w postaci tunelu wydrążonego pod masywem Opalonego###.
### czasem życie dopisuje swój własny komentarz. W momencie wysyłania tego opracowania na serwer, właśnie trwała akcja ratownicza pod Przeł. Szpiglasową. 30.12.2001 pod lawiną zginęło dwóch turystów, a nieco później jeszcze dwóch ratowników GOPR. W odróżnieniu od ludzi, reakcje chemiczne biegną zawsze drogą najłatwiejszą...
Teraz analogie chemiczne. Podczas przysuwania do siebie reagujących cząsteczek pojawiają się siły odpychające - nawet w przypadku reakcji egzotermicznych. Siły te mogą być bardzo znaczne, jak w przypadku syntezy wodoru z tlenem. Niekiedy mogą to być siły odpychania elektrycznego, jak chociażby podczas reakcji: MnO4– + C2O42– . Ten rodzaj odpychania szczególnie często występuje w reakcjach redukcji-utleniania, natomiast będzie oczywiście o wiele mniejszy dla reakcji np.: H+ + OH–. Dlatego wiele reakcji redoks jest procesami powolnymi, w odróżnieniu od reakcji zobojętnienia.
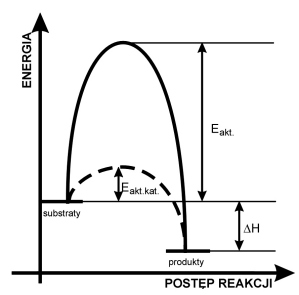
Zderzenie dwóch cząsteczek substratów prowadzi do zajścia reakcji syntezy tylko wtedy, gdy suma energii kinetycznej obu cząsteczek jest większa od owej progowej energii tzw. aktywacji. Im mniejsza energia aktywacji procesu, tym (w danej temperaturze) więcej cząsteczek spełnia ten warunek, a więc tym szybciej przebiega ta reakcja. Na powyższym schemacie przedstawiono przebieg zmian energii przy przejściu od substratów, w produkt:
substrat A + substrat B ® produkt
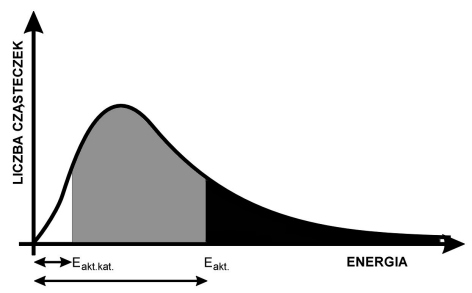
Energia aktywacji Eakt. może być bardzo znaczna. Na następnym wykresie przedstawiono zależność liczby cząsteczek mających określoną (przypadkową) energię kinetyczną, od wartości tej energii. Liczba cząsteczek, których energia jest większa od Eakt. jest proporcjonalna do pola powierzchni (całki oznaczonej), zaznaczonego na czarno.
W obecności katalizatora możliwe jest przekształcenie substratów w produkty - w inny, pośredni sposób. Cząsteczka jednego z substratów reaguje z cząsteczką katalizatora KAT, dając nietrwały kompleks:
substrat A + KAT ® kompleks
kompleks ten reaguje następnie z cząsteczką drugiego substratu, dając cząsteczkę produktu oraz cząsteczkę katalizatora
kompleks + substrat B ® produkt + KAT
Sumaryczny wynik obu sposobów jest identyczny. Jeśli jednak używa się katalizatora, to w jego obecności proces może biec inną drogą - poprzez pośrednie tworzenie zupełnie innych kompleksów aktywnych, dla których to procesów energie aktywacji mogą być znacznie mniejsze niż dla bezpośredniej reakcji niekatalizowanej. Na górnym wykresie reakcji katalizowanej odpowiada znacznie niższa (linia przerywana) energia aktywacji: Eakt.kat.. W identycznych jak poprzednio warunkach temperatury, znacznie więcej cząsteczek ma energie przekraczające tę zmniejszoną wartość progową. Na dolnym wykresie odpowiada temu pole oznaczone szarym + czarnym kolorem łącznie.
O szybkości reakcji decyduje więc energia aktywacji. Szybkie reakcje - to reakcje o małej energii aktywacji. W reakcji nadmanganianu ze szczawianem katalitycznie działają jony Mn2+. Energia aktywacji tego procesu jest znacznie mniejsza chociażby z powodu przeciwnych ładunków cząsteczek substratów. Kationy Mn2+ reagują najpierw z anionami MnO4– tworząc produkt pośredni, reagujący dalej z anionem szczawianowym. Bardzo często katalitycznie działa zakwaszenie roztworu. Protonowanie jednej z cząsteczek może powodować zmiany ładunków ułatwiające atak cząsteczki drugiego reagenta. Ten mechanizm działania katalizatora można więc porównać z obniżeniem poprzeczki...
Czasami słyszy się definicję katalizatora, jako substancji nie biorącej udziału w reakcji, przyspieszającej jedynie szybkość procesu. Zapewne bierze się to stąd, że w sumarycznym równaniu reakcji katalizatora nie ma. Nie jest to oczywiście prawda. Katalizator bierze materialny udział w reakcji (np. w równaniu kinetycznym występuje jego stężenie, i to często w potędze o wysokim wykładniku!). W obecności katalizatora proces biegnie inną, dłuższą drogą, o mniejszych jednak energiach aktywacji.
Na pierwszym wykresie symbolem DH oznaczono sumaryczny wynik energetyczny reakcji (entalpia procesu). Efekt energetyczny reakcji niekatalizowanej jest identyczny, jak dla procesu biegnącego w obecności katalizatora. W reakcjach odwracalnych użycie katalizatora prowadzi do stanu równowagi, w którym stężenia reagentów są identyczne, jak dla procesu niekatalizowanego. Tyle tylko, że stan równowagi szybciej się ustala. W powieściach science-fiction pojawia się czasem pomysł polegający na wynalezieniu katalizatora rozkładającego w temperaturze pokojowej wodę na mieszaninę wodoru i tlenu. Tę mieszaninę odprowadza się rurociągiem, spala (otrzymując energię), a następnie po skropleniu (dodatkowa produkcja energii), zawraca wodę do naczynia z katalizatorem. Czyżby chemiczne perpetuum mobile i rozwiązanie światowego problemu energetycznego? Niestety, rzecz w tym, że katalizator nie może umożliwiać procesu, który w danych warunkach (tu: temperaturowych) jest niemożliwy... W zwykłej temperaturze woda jest trwała, i żaden katalizator nie może zmienić tego faktu. Gdyby zaś nawet możliwy z powodów termodynamicznych był rozkład wody w zwykłej temperaturze, to z kolei mieszanina wodoru i tlenu nie mogłaby być palna...
Katalizatory mogą jednak być niemal cudownymi substancjami... Rzecz w tym, że czasem z mieszaniny dwóch substratów może powstawać bardzo wiele różnych produktów. Dobierając odpowiedni katalizator można spowodować, że dominować będzie tylko jeden, pożądany proces. Najlepszym przykładem jest wykorzystanie przemysłowe tzw. "gazu syntezowego", czyli mieszaniny CO i H2. Dobierając odpowiednio proporcje składników, warunki fizyczne, oraz skład katalizatora, można na skalę przemysłową prowadzić z doskonałą wydajnością zupełnie różne syntezy: benzyny, parafiny (węglowodory), metanolu, etanolu, formaldehydu, estrów.
Jeśli nie stosujemy katalizatora, to nawet dla reakcji o wysokiej energii aktywacji można łatwo zwiększyć procent cząsteczek mających energię większą od owej wartości progowej. Wystarczy zwiększyć ich energię kinetyczną, czyli po prostu podgrzać naczynie...
Jeśli energie aktywacji procesów z udziałem cząsteczki katalizatora są większe niż dla procesów bezpośrednich, to wydawałoby się, że obecność takiej substancji powinna spowalniać reakcję (inhibicja). Oczywiście tak się nie dzieje, gdyż pomimo obecności tej substancji, może przecież biec szybsza reakcja bezpośrednia! Mechanizm działania inhibitorów polega z reguły na szczególnie skutecznym usuwaniu ze środowiska reakcji, katalizatorów procesów (lub substancji o charakterze autokatalizatorów). Czasami inhibitory mogą jednak blokować centra aktywne cząsteczek substratów.
** Jeszcze jedna ciekawostka: okazuje się, że wariant reakcji katalizowanej, pomimo niższej energii aktywacji, może z innych powodów (np. sterycznych) być reakcją wolniejszą, niż droga niekatalizowana! Nawet w takim przypadku użycie katalizatora daje w sumie efekt przyspieszenia tempa, bo oprócz reakcji bezpośredniej biegnie dodatkowo inny proces, który w sumie przyczynia się do wzrostu tempa powstawania produktu - na obu drogach łącznie.**
dydaktyka przy pomocy kija...
Dla ożywienia i wsparcia procesu dydaktycznego czasem posługuję się Kijem Dydaktycznym. Na wykład przynoszę długi kij od szczotki, z zawieszoną kartką: „to jest model energii aktywacji”; kij umocowuję poziomo, w poprzek przejścia między ławkami, na pewnej umiarkowanej wysokości. Część Studentów z pewną (różną!) łatwością radzi sobie z pokonaniem przeszkody. Wiele osób rezygnuje z konfrontacji z zaskakującą niespodzianką i omija przeszkodę idąc do swoich miejsc okrężną drogą. Jest ich tym więcej, im wyżej umieszczona jest poprzeczka... Komentuję to potem właśnie jako model procesu katalitycznego - przez wykorzystanie możliwości osiągnięcia celu inną, dłuższą lecz łatwiejszą drogą.
Istnieje przekonanie, że warianty drogi katalizowanej są szybsze niż reakcja bezpośrednia. Nie musi tak być zawsze. Niech modelem będzie rozładowanie korka na autostradzie. Zarządza się kilka równoległych objazdów zwężenia lokalnymi drogami gruntowymi, lub wręcz przez pole. Objazdy odbywają się z szybkością o wiele mniejszą niż zwężonym odcinkiem autostrady, ale stanowiąc DODATKOWĄ możliwość ruchu powodują szybsze rozładowanie zatoru - i szybsze dotarcie do celu całemu zbiorowisku.
Okazuje się że użycie Kija Dydaktycznego może być metodą podnoszenia skuteczności dydaktyki. W dawnych czasach posługiwano się nim w zgoła inny sposób, lecz tamta dawna metoda zdawała się zabezpieczać przed zupełnie innymi skutkami, które dziś są prawdziwą plagą polskich szkół. Jeśli teraz odzywają się głosy o przywrócenie starych drastycznych sposobów, to winę ponoszą ci, którzy przez wiele lat niedopuszczalnego liberalizmu (niedopuszczalnego, bo z wyłączeniem rozumu) dopuścili do obecnej dramatycznej sytuacji...
LITERATURA
J.Chem.Educ. 75, 658 (1998). [Spontaniczność, samorzutność i
nieodwracalność]
SUWAK ZAMKA BŁYSKAWICZNEGO I EFEKT STERYCZNY KATALIZATORA (DRUGI MECHANIZM DZIAŁANIA KATALIZATORA)
Opisując mechanizm działania katalizatora często sięga się do porównania z dopasowaniem klucza i zamka patentowego. Porównanie to może być dobrą analogią do stereospecyficzności katalizatora (w szczególności niektórych enzymów), jest jednak niezbyt trafne w stosunku do opisu samego funkcjonowania katalizatora.
Do skutecznego dokonania aktu reakcji chemicznej niezbędne jest oczywiście, żeby suma energii obu reagujących cząsteczek była dostatecznie duża #.
# "dostatecznie duża" = większa od pewnej wartości progowej
To jednak nie wystarcza, jeśli chociaż jedna z cząsteczek ma wydłużony, niesymetryczny kształt. Do skutecznego aktu reakcji prowadzą tylko takie zderzenia, podczas których cząsteczki są "prawidłowo" wzajemnie usytuowane w przestrzeni. Im cząsteczki są bardziej wydłużone i niesymetryczne, tym mniej prawdopodobne jest przypadkowe takie właśnie ich ustawienie. Jeśli kształt cząsteczek jest szczególnie złożony, to pomimo spełnienia wymogu energetycznego, tylko bardzo nikły procent takich zderzeń prowadzi do zajścia aktu reakcji syntezy. Jeden z mechanizmów działania katalizatora polega na wymuszeniu najkorzystniejszego ustawienia przestrzennego obu cząsteczek (efekt steryczny).
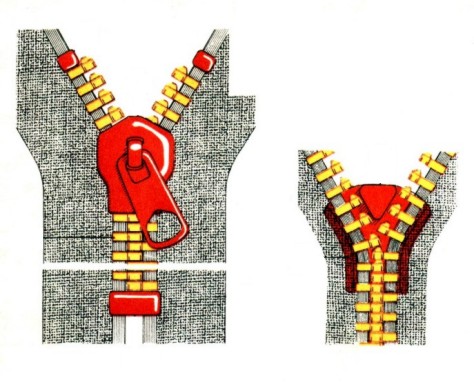
Doskonałym modelem jest działanie suwaka zamka błyskawicznego. Każdy z nas zapewne próbował ręcznie spiąć ogniwka zamka "rozprutego" przypadkowo poniżej suwaka. Irytująca bezskuteczność tych prób wynika zarówno z potrzeby użycia znacznej siły, jak i konieczności niezmiernie precyzyjnego wzajemnego ustawienia łączonych ogniwek względem siebie. Najmniejsze odchylenie powoduje, że połączenie staje się niemożliwe!
Suwak zamka ma dwie wnęki, których kształt bardzo ściśle odpowiada kształtowi ogniwek. Ogniwa zostają wprowadzone w owe wnęki, a ich dopasowanie uniemożliwia jakiekolwiek przypadkowe odchylenie. Przesuwany suwak zamka zmusza wachlarzowato odchylone ogniwa do wzajemnego zazębienia. Jedno pociągnięcie suwaka powoduje iście "błyskawiczne" połączenie wielu dziesiątków elementów. I to praktycznie bez żadnego oporu!
Najbardziej charakterystyczne są zmiany w trakcie reakcji z udziałem enzymów. Cząsteczka katalizatora tworzy kompleks z cząsteczkami substratów. W kompleksie tym cząsteczka katalizatora-enzymu wymusza optymalne dla reakcji ułożenie cząsteczek substratów w przestrzeni ("efekt steryczny"). W trakcie tworzenia kompleksu również w cząsteczce enzymu następują zmiany budowy przestrzennej.
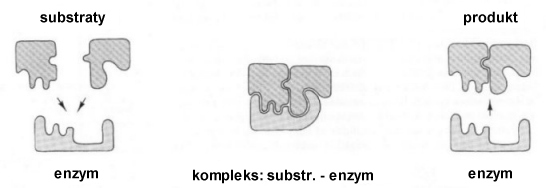
Po utworzeniu produktu, cząsteczka enzymu zostaje uwolniona, przybiera pierwotny kształt i wchodzi ona w reakcję tworzenia kompleksu z kolejnymi cząsteczkami substratów. Taki cykl przemian nosi nazwę obrotu enzymu. Imponująca jest sprawność niektórych enzymów. W przypadku katalazy lub anhydrazy węglanowej, w optymalnych warunkach stężeń substratów i temperatury, enzymy te wykonują ok. miliona obrotów w ciągu minuty!
Powolne reakcje chemiczne są to procesy w których istnieje :
szczególnie wielka energia aktywacji lub
szczególnie skuteczna przeszkoda steryczna
"życiowa strategia"
Organizmy żywe wykorzystują termodynamicznie niestabilne układy reagentów; ta właśnie niestabilność jest źródłem energii na potrzeby życiowe. Do tego celu wykorzystywane są jednak powolne reakcje chemiczne (gdyby były to procesy szybkie, to energia wyzwoliłaby się w ułamku sekundy, powodując zapewne silny wzrost temperatury i zniszczenie organizmu!). Jako pierwotne źródła energii wykorzystywane są przede wszystkim reakcje redukcji-utleniania. Z powodów podanych wcześniej, wśród nich właśnie jest szczególnie wiele procesów powolnych. Substraty te są przechowywane w komórce, a powolność reakcji jest zabezpieczeniem przed niekontrolowanym ich zużyciem. W miarę potrzeb życiowych organizmu, procesy wyzwalania energii są regulowane poprzez kontrolowane dostarczanie katalizatora-enzymu.
Podobna jest strategia gromadzenia substancji zapasowych. Zgromadzenie ilości glukozy, niezbędnej do przetrwania niesprzyjającego okresu, jest niemożliwe (musiałby to być np. nasycony roztwór!). Glukoza przekształcana jest w ziarna praktycznie nierozpuszczalnej (a więc nie zajmującej zbyt wiele miejsca) skrobi. Skrobia jest w wodnym roztworze termodynamicznie nietrwała, ale z różnych powodów (m.in. sterycznych) hydroliza skrobi jest procesem niezwykle powolnym. W miarę potrzeb organizmu, samorzutny proces hydrolizy skrobi może być w każdej chwili uruchomiony - poprzez dostarczenie enzymu: amylazy. Również celuloza zbudowana jest z reszt glukozy (w nieco tylko inny sposób powiązanych, niż w cząsteczce skrobi). Ponieważ jednak celuloza w organizmach roślinnych spełnia funkcję budulcową - w odróżnieniu od skrobi powinna ona być bardzo odporna na degradację, pomimo że podobnie jak skrobia, celuloza jest termodynamicznie nietrwała. Reszty glukozowe w cząsteczce celulozy są związane w sposób, który bardzo znacznie utrudnia dostęp cząsteczek enzymu do wiązań glikozydowych (do tego dochodzi drugorzędowa struktura równoległych wiązek cząsteczek celulozy). W taki prosty sposób termodynamicznie nietrwała cząsteczka celulozy okazuje się być wystarczająco stabilna kinetycznie - przynajmniej w porównaniu z czasem życia macierzystego organizmu rośliny.
## ten czas życia bywa u niektórych roślin imponująco długi; wiek niektórych drzew znacznie przekracza 1000 lat!
### stabilność celulozy spędza sen z powiek agronomów. Zdecydowaną większość biomasy na Ziemi stanowi właśnie celuloza. Mogłaby ona być niewyczerpanym źródłem paszy w hodowli zwierząt. Niestety, celuloza jest tak dokładnie "zabezpieczona" kinetycznie, że tylko nieliczne zwierzęta potrafią wykorzystać to źródło pokarmowe; powszechnie znana jest taka zdolność termitów (ulubiony temat "kreskówek" Disney'a), a w mniejszym stopniu - przeżuwaczy. Zupełnie poprawnie: tę pracę wykonują drobnoustroje za pomocą enzymu celulazy, a zwierzęta zapewniają im jedynie warunki rozwoju i surowiec. Przemysłowe próby podobnego wykorzystania celulozy dotąd się nie powiodły...
LITERATURA
Młody Technik. Nr.2
(1984). [Suwak zamka błyskawicznego]
Tomasz Pluciński
nowy adres:
tomasz.plucinski@ug.edu.pl
| F | strona główna |