FENOLOFTALEINA: substancja mało znana…
Fenoloftaleina pod wpływem dodatku zasad barwi się na czerwono, a po dodaniu kwasów – jest bezbarwna.
Ponieważ fenoloftaleina zmienia barwę w zakresie odczynu zasadowego, służy do wykrywania zasad (podobnie i odwrotnie: oranż metylowy - do wykrywania kwasów).
Twierdzenia te mogą być zupełnie błędne…
Po dodaniu zasady – bezbarwna?
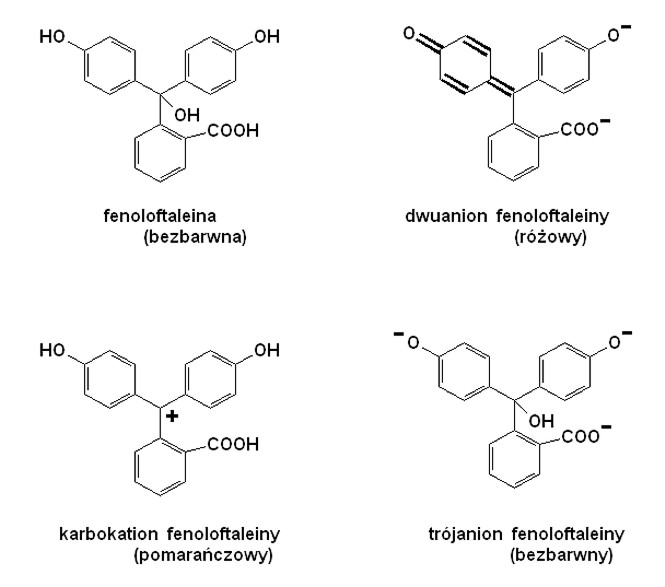
Do 1-2 kropel roztworu fenoloftaleiny dodać kilka kropel dość stężonego (15-20 procentowego) roztworu NaOH. Powstaje malinowe zabarwienie, które jednak po kilkudziesięciu sekundach staje się coraz mniej intensywne. W razie potrzeby dodać więcej NaOH. Otrzymuje się praktycznie bezbarwny roztwór. Utworzenie dwuanionu fenoloftaleiny powoduje powstanie układu wiązań chinoidowych będących powodem barwności. Natomiast w bardzo silnie zasadowym środowisku powstaje sól trójsodowa, której trójanion jest bezbarwny. Biegnie niemal nieodwracalny powolny proces podstawienia anionem wodorotlenkowym środkowego atomu węgla, powodujący powstanie bezbarwnego układu aromatycznego. Jest interesujące, że na szybkość tego procesu może mieć istotny wpływ obecność środków powierzchniowo czynnych. Dodatek kationowych detergentów (Sterinol) przyspiesza odbarwienia, a dodatek detergentów tworzących ujemnie naładowane micele (mydło, Kokosal) - spowalnia tę reakcję. Podobne efekty daje Fiolet Krystaliczny.
Roztwór rozcieńczyć wodą, a następnie wkraplać 10-15 procentowy roztwór kwasu siarkowego. Pojawia się dość intensywna barwa różowa! Niewielkie ilości soli trójsodowej przekształcają się ponownie w barwny dwuanion. Oczywiście dalsze zakwaszenie powoduje ostatecznie zanik barwy, ale jest faktem, że roztwór (bezbarwny) fenoloftaleiny pod wpływem dodatku kwasu staje się czerwony!
Jeśli kroplę roztworu fenoloftaleiny dodać do 1-2 ml stężonego kwasu siarkowego, powstaje pomarańczowe zabarwienie pochodzące od karbokationu fenoloftaleiny. Po wlaniu tego roztworu do większej ilości wody, zabarwienie znika.
Budowę handlowej formy fenoloftaleiny lepiej przedstawia struktura laktonowa

Wykrywanie kwasów
Typowy problem analityczny: czy biały proszek na szkiełku zegarkowym – jest kwasem? Jakiego użyć wskaźnika; oranżu metylowego czy fenoloftaleiny? Ponieważ zakres zmiany barwy oranżu przypada dla odczynu słabo kwasowego, a dla fenoloftaleiny - zasadowego, wybór jest na pozór oczywisty: oranż metylowy.
No, to do próbki kwasu borowego H3BO3 dodać dwie krople roztworu oranżu metylowego (lub użyć uniwersalnego papierka wskaźnikowego). Wynik testu jest negatywny: pomarańczowe zabarwienie nie powstaje.
Powód jest następujący. Wskaźnik pH jest sprzężoną różnobarwną parą kwas-zasada. Zmiana barwy jest skutkiem silnego zakłócenia równowagi dysocjacji wskaźnika - po dodaniu kwasu. Aby to nastąpiło, dodany kwas musi być znacznie mocniejszym kwasem niż kwasowa forma wskaźnika. A kwasowa forma oranżu metylowego jest dość silnie kwasowa (pKa = ok. 4), podczas gdy testowany kwas borowy – jest skrajnie słabo kwasowy (pKa = ok. 10). Nie może więc mieć wpływu na dysocjację tego wskaźnika. Oranż metylowy nadaje się więc do wykrywania obecności tylko niezbyt słabych kwasów. Do identyfikacji skrajnie słabych kwasów należy użyć wskaźnika, którego forma kwasowa jest skrajnie słabo kwasowa. Takim wskaźnikiem jest - paradoksalnie - fenoloftaleina! Oczywiście: fenoloftaleina w formie czerwonych anionów. Odczynnik sporządza się przez dodanie do kropli roztworu fenoloftaleiny w 1-2 ml wody – kropli bardzo rozcieńczonego roztworu NaOH. Do takiego czerwonego roztworu dodać porcję kwasu borowego: czerwone zabarwienie natychmiast znika! Test identyfikacji właściwości kwasowych kationów amonowych (NH4Cl) daje wynik mniej przekonujący. Należy posłużyć się jeszcze czulszym odczynnikiem - sporządzonym z tymoloftaleiny. Zakres zmiany barwy tymoloftaleiny przypada dla wyższych wartości pH niż u fenoloftaleiny; dlatego tymoloftaleina jest mniej czułym wskaźnikiem przy wykrywaniu mocnych zasad, niż fenoloftaleina. Natomiast niebieski anion tymoloftaleiny jest bardziej czułym wskaźnikiem do identyfikacji słabych kwasów. Jest to podstawą działania atrakcyjnej chemicznej zabawki jaką jest "znikający atrament". Oczywiście odczynniki te nadają się również do identyfikacji mocnych kwasów.
kwasyizasady o innych
metodach wykrywania kwasów i zasad
http://pl.wikipedia.org/wiki/Fenoloftaleina
przedstawione wzory odpowiednich form fenoloftaleiny
Tomasz Pluciński
nowy adres:
tomasz.plucinski@ug.edu.pl
| F | strona główna |