Errata do egzemplarza autorskiego książki: **ostatnia aktualizacja 17.11.2015**
"Doświadczenia chemiczne",
wyd. "Adamantan", 1997
na str. 4 adres e-mailowy został zniekształcony przez edytor tekstu; po słowie "sun" powinna być jedynka, która w druku jest łudząco podobna do litery "el".
Nowy adres mailowy: tomasz.plucinski@ug.edu.pl Zachęcam do lektury autorskiej strony www: http://www.tomek.strony.ug.edu.pl/ która zawiera sporo uzupełnień oraz nowych opisów.
na str. 11 autorami książki "Metale w naszym domu" są: Aleksandra i Stefan Sękowscy.
na str. 12 zmienić: Jest możliwość korespondencji na tematy chemiczne za pośrednictwem grupy dyskusyjnej pl.sci.chemia. Istnieje prócz tego lista dyskusyjna CHEMFAN i jej bogata w różnorodne chemiczne zasoby strona internetowa: http://www.man.lodz.pl/CHEMFAN/.
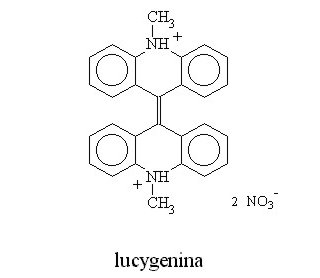
na str. 13 poprawić wzór lucygeniny:

na str. 76 na wykresie zamiast oznaczenia "Uo", wpisać: "Ug".
na str. 90 jest nieścisłe sformułowanie, gdyż toksyczny tlen w stanie singletowym może występować w komórkach, nie jest on jednak produktem redukcji tlenu!
na str. 105 uzupełnić na rysunkach oznaczenie ładunków anionów: chlorkowego i azotanowego.
na str. 114 powinno być: "miceli" zamiast "micelli".
na str. 140 i 141 zamienić miejscami rysunki.
** na str. 147 dodać: "
Ten eksperyment należałoby wycofać z opisu. W podwyższonej temperaturze parowanie toksycznej rtęci jest bardzo intensywne. Co prawda para Hg jest przezroczysta i bezbarwna, ale można ją doskonale śledzić w UV na tle fluoryzującego ekranu. http://www.youtube.com/watch?v=lpZF88fqrl8 Ten widok jest dramatycznie zniechęcający do eksperymentu! Wykonanie go w zamkniętym pomieszczeniu jest bardzo ryzykowne, a każde uwolnienie rtęci do środowiska jest wysoce naganne. Za takie należy uznać metody powszechnie stosowane przez poszukiwaczy złota "na dziko", w Ameryce Południowej. Końcowy etap polega na odparowaniu rtęci z amalgamatu w garnku umieszczonym w ognisku (...!). Podobnie należy potraktować inny ulubiony eksperyment: spalanie "Węża Faraona". Warto również obejrzeć parowanie rtęci z amalgamatowego wypełnienia zęba sprzed 25 lat... Agresywna korozja stopów aluminium po kontakcie z rtęcią jest powodem rygorystycznej kontroli czy na pokład samolotu podróżny nie wnosi termometru rtęciowego. Po ew. jego stłuczeniu, ciężkie ruchliwe krople rtęci wcześniej czy później wpadają przez drobne szczeliny na dno kadłuba i powodują destrukcję poszycia metalowego.
doświadczenie z rozgrzewającym się amalgamatem glinu może być bardzo ryzykowne. Objawia się to w pełni przy obserwacji z lampą UV: widać wytwarzającą się gęstą ciemną chmurę par rtęci! Zalecam zrezygnowanie z tego eksperymentu." **
na str. 148 zmienić: Kurier Chemiczny, 1992, nr 6 (12), s. 1; 1993, nr 1 (13), s. 17. [Amalgamaty]
na str. 186 równanie opisuje reakcję z N,N-dwumetylo-p-fenylenodwuaminą, a nie z N,N-dwumetyloaniliną.
na str. 199 w drugim równaniu powinno być: + 6SO42-
na str. 206 poprawić: J.Am.Chem.Soc., 70, 1640 (1948). [Warunki stechiometryczności reakcji MnO4- + H2O2] dopisać: Roczniki Chemji, 135, (1921).
na str. 210 9g powinno być: + (a/2-b)(COO)22-
na str. 211 zamienić podpisy pod rysunkami: pod lewym - "zielony", pod prawym - "żółty".
na str. 220 Masa litra powietrza równa jest ok. 1,3 g, a nie 1,4 g.
na str. 223 Sacharyna jest to imid kwasu o-sulfobenzoesowego, a nie kwasu o-toluenosulfonowego.
na str. 228 Bardzo słabe zasady można miareczkować w kwasie octowym, dzięki efektowi wyrównującemu tego rozpuszczalnika. Efekt różnicujący opisany jest w następnych zdaniach.
na str. 229 15g powinno być: + [(NH3)5CoIII-O-O-CoIII(NH3)5]4+ (brązowy)
na stronach: 9, 10, 29, 35, 53, 67, 113, 227, 233 - przy wzmiankach o użyciu błękitu metylenowego, tioniny, fioletu krystalicznego, rodaminy B, fluoresceiny, eozyny i rywanolu, dodać ostrzeżenie: Zachować ostrożność: rozsypana przypadkowo sucha substancja silnie plami podłoże.
na str. 11 dopisać : H.Römpp, H.Raaf, "Chemia organiczna w probówce", WNT, Warszawa 1990.
na str. 15 zmienić: świecąca kolba. Kawałeczek białego fosforu, wielkości ziarnka ryżu, rozpuścić w 5-10 ml dwusiarczku węgla CS2 umieszczonego na dnie okrągłodennej kolby o pojemności 250-500 ml, ze szlifem. Uwaga: jest to ciecz niezwykle łatwopalna, silnie trująca i mająca wyjątkowo odrażający zapach. Należy unikać przelewania roztworu, gdyż grozi to samozapłonem. Kolbę połączyć za pośrednictwem uszczelnionej smarem szlifowej nasadki zaopatrzonej w kran, z próżniową pompką wodną. Podczas odparowywania dwusiarczku węgla kolbę obracać tak, aby na ściankach utworzyła się cienka warstewka białego fosforu. Po zakończeniu odparowywania zamknąć kran nasadki i odłączyć aparaturę od pompki. Po wyłączeniu światła powoli otworzyć kran, pozwalając aby powietrze stopniowo dostało się do kolby. Wnętrze kolby zaczyna świecić. Czasami obserwuje się pulsujące, szybko przesuwające się koncentryczne fale świecenia. Jest to interesująca wersja pokazu wędrujących fal reaktywności chemicznej (por. str. 84).
na str. 16 uzupełnić przypis u dołu strony: Odpadki białego fosforu można również skutecznie zlikwidować przez zalanie ich na kilka godzin nasyconym roztworem CuSO4.
na str. 26 dopisać: Latarkę chemiczną można sporządzić następująco: do polietylenowego pojemnika po "fiksanalu" wsypać ok. 10 g suchych granulek KOH, wlać ok. 10 ml DMSO i umieścić kapilarną rurkę szklaną, w której zatopiono przedtem (wymaga to pewnej wprawy) roztwór kilkunastu mg luminolu w ok. 0,1 ml DMSO. Można dodać do pojemnika odrobinę stałego nadboranu sodu NaBO3, lub "pertlenonu", czyli mocznikowego klatratu nadtlenku wodoru. Wlot plastikowej gilzy zatopić w płomieniu (rozgrzać i zacisnąć pincetą). Latarkę uruchamia się przez silne zgięcie pojemnika, aż do rozłamania szklanej kapilary i energiczne wstrząsanie.
na str. 30 dopisać: Chlorofil zawarty w zdrowych tkankach roślinnych fluoryzuje bardzo słabo. Od pewnego czasu, za pośrednictwem sztucznych satelitów prowadzona jest kontrola stanu środowiska w skali globalnej. Na zdjęciach satelitarnych dokonywanych przy odpowiedniej długości fali, obszary skażone i uszkodzone wyróżniają się na skutek zwiększonej intensywności fluorescencji.
na str. 33 dopisać w tabeli: chinina, zakres pH zmiany fluorescencji: 3,0-5,0; barwa fluorescencji: niebieska. dopisać pozycję literaturową: Wiedza i Życie, lipiec 1997, s. 26. [Chinina w "tonicu"]
na str. 39 dopisać: Jest paradoksem, że ozon w dolnych warstwach atmosfery, wytwarzany w trakcie różnych procesów przemysłowych, jest szkodliwy. Zawartość ozonu w dolnych warstwach atmosfery monitorowana jest podobnie jak trujących tlenków azotu, CO i SO2.
na str. 40 dopisać pozycję literaturową: J.Chem Educ., 74, 51 (1997). [środki ekranujące UV]
na str. 41 dopisać: Fotouczulenia nie należy lekceważyć. Po kontakcie z tzw. barszczem pastewnym (okazały krewniak pietruszki) mogą wystąpić poważne oparzenia połączone z głęboką martwicą tkanek. Może być konieczne przeszczepianie skóry. W lecie 1997 w Zakopanem niszczenie tej niebezpiecznej rośliny zlecono wyspecjalizowanej firmie.
na str. 66 dopisać: Jeśli wziąć pod uwagę małą wartość stałej równowagi uwadniania CO2, to okaże się, że kwas węglowy jest kwasem o mocy podobnej, jak kwas octowy! Niektóre źródła podają wartość K = 400.
na str. 67 w spisie literatury dodać: F.Seel, "Podstawy chemii analitycznej", PWN, Warszawa 1960, s. 160.
na str. 77 dopisać pozycję literaturową: Chemia w Szkole, 24, (1991). [Modele Lotki]
na str. 83 dopisać: do oleju można dodać odrobinę pyłu aluminiowego.
na str. 84 przy: "Wędrujące fale reaktywności..." proponuję zmienić przepis na nieco prostszy. Po substratach: H2SO4, KBrO3, usunąć opis sporządzania oddzielnie roztworów kwasu malonowego i KBr, a wstawić procedurę: Sporządzić roztwory: A: w 10 ml wody rozpuścić 1 g kwasu malonowego oraz 0,5 g KBr B: do 36 ml wody destylowanej dodać 1 ml stężonego kwasu siarkowego oraz 2,5 g KBrO3 C: (opis 0,025 M roztworu ferroiny pozostawić bez zmian.) 6,5 ml roztworu B przelać do małej kolbki ze szklanym korkiem i dodać 1 ml roztworu A. Kolbkę zamknąć... (dalszy opis bez zmian).
na str. 85 dopisać pozycje literaturowe: Nature, 366, 322 (1993). [Makrofotografie "jądra" emitującego fale] J.Phys.Chem. 100, 13132 (1996). [Oscylacje, fale i chaos]
na str. 92 dopisać pozycje literaturowe: Wiedza i życie, maj 1997, s. 56. ["Skazani na starość"] Wiedza i życie, maj 1995. ["Cząsteczkowa artyleria"] G.Bartosz, "Druga twarz tlenu", PWN, Warszawa 1995.
na str. 96 dopisać: Polifenole są składnikami substancji garbnikowych (tanina) zawartych w roślinach. Garbniki są przypuszczalnie swoistą bronią chemiczną roślin, służącą do ochrony przed zjadaniem ich przez zwierzęta.
na str. 99 i 236 ironiczne uwagi na temat praktyk reklamowych należy uzupełnić, gdyż w międzyczasie rozpoczęto reklamę zupełnie nowych wyrobów: "TAED-System Super", "TAED-System Super Ekstra", "TAED-System Super Ekstra Dwufazowy". Z niecierpliwością czekamy na "TAED-System Super Ekstra Dwufazowy PLUS!"
na str. 109 Efekt "odpychania" wody przez hydrofobowe substancje można wykazać w równie prosty, jak pożyteczny sposób. W domowych lodówkach bardzo uciążliwe jest narastanie szronu na drzwiczkach zamrażalnika, co zawsze prowadzi do ich mechanicznego uszkodzenia. Można temu zapobiec przez posmarowanie tamponem z waty nasączonym w oleju parafinowym krawędzi obudowy zamrażalnika oraz krawędzi drzwiczek. Dla porównania, pozostawić niewielki fragment nie pokryty olejem. Różnica będzie wyraźnie widoczna już po kilku dniach.
na str. 114 dopisać pozycję literaturową: J.Chem Educ., 74, 556 (1997). [Reakcje z pochodną fenoloftaleiny]
na str. 129 dopisać w połowie strony: Jak zaskakujące i mylące mogą być różne efekty podczas elektrolizy, przekonali się na własnej skórze odkrywcy tzw. "zimnej fuzji jądrowej" [J.Chem.Educ., 68, 277 (1991).] Obecnie przyjmuje się, że prawa Faradaya są spełniane równie bezwzględnie, jak prawo zachowania masy. Jeśli w jakimś eksperymencie stwierdza się doświadczalnie pozorne odstępstwa od praw Faradaya, oznacza to, że na elektrodzie zachodzi dodatkowy proces elektrochemiczny, którego produkty są trudne do zaobserwowania w danych warunkach.
na str. 133 dopisać po ostatnim równaniu reakcji: ;gęstość elektrolitu w akumulatorze ołowiowym może więc być wygodną miarą stopnia jego naładowania.
na str. 134 dodać: Pomimo, że niklowo-kadmowe akumulatorki dają niższe napięcie (1,2 V), najczęściej mogą one doskonale zastępować zwykłe baterie 1,5 V. W przenośnych magnetofonach różnicę tę kompensuje system kontroli silnika. Niebezpieczne może być jednak użycie akumulatorów w popularnych aparatach fotograficznych z lampą błyskową. Akumulatorki Ni-Cd mogą bowiem dawać znacznie większą moc, co może spowodować uszkodzenie przetwornicy lampy błyskowej, i to pomimo niższego napięcia zasilającego.
na str. 135 dopisać: Do celów praktycznych najlepiej stosować zestaw czterech identycznych prostowników elektrolitycznych połączonych w układ mostkowy Graetza.
na str. 138 po ostatnim zdaniu dopisać: W drugim, zarówno na katodzie, jak i anodzie (!), powstaje wodór.
na str. 143 dopisać pozycję literaturową: J.Chem. Educ., 74, 819 (1997). [Przepływ jonów podczas pracy ogniwa]
na str. 158 dopisać pozycję literaturową: J.Chem. Educ., 74, 421 (1997). [Polipirol]
na str. 161 dopisać: Wytrącony osad magnetytu nabiera właściwości magnetycznych po kilku minutach. W tym czasie następuje rekrystalizacja osadu.
na str. 178 dopisać pozycje literaturowe: Chemia w Szkole, 221 (1983). [Tonowanie, regeneracja srebra] Chemia w Szkole, 177 (1968). [Regeneracja srebra]
na str. 188 dopisać odnośnik literaturowy: Kurier Chemiczny, 1996, Nr 1-3, s. 4. [Wskaźnik chiralności]
na str. 193 dopisać: Do mieszaniny roztworu jodku i jodanu można dodawać znaczne ilości kwasu np. solnego, a odczyn mieszaniny pozostaje zbliżony do neutralnego. Mieszanina taka jest więc niezwykle skutecznym buforem w stosunku do dodawanego kwasu. Aby uniknąć powstawania brunatnego jodu, wygodniej posługiwać się buforem o składzie: KI + KIO3 + Na2S2O3.
na str. 203 dopisać: Czytelnik zechce (...) dla różnych wartości parametru x, na przykład x=0, x=1, x=4/3.
na str. 204 dopisać na początku pozycję literaturową: Wiadomości Chemiczne, 50, 829 (1996).
na str. 216 dopisać: Dodatek jednej kropli perhydrolu (30-procentowego roztworu utleniacza (!) nadtlenku wodoru) również bardzo skutecznie blokuje utlenianie etanolu kwasem azotowym.
na str. 218 dopisać pozycję literaturową: M.Langner, A.Podgórecka, "Ćwiczenia i demonstracje z chemii ogólnej i nieorganicznej z uwzględnieniem wskazówek metodycznych", PWN, Łódź, Warszawa 1959, s. 267. [Inhibicja nadtlenkiem wodoru]
na str. 225 dopisać pozycję literaturową: Wiadomości Chemiczne, 223, 47 (1966). ["Flawonoidy w żywności"]
na str. 230 dopisać pozycję literaturową: Kurier Chemiczny, 1996, Nr 1-3, s. 4. [Li3Co(CN)5× 2DMF]
na str. 233 wartość potencjału standardowego redoks dla błękitu metylenowego wynosi E0 = 0,53 V.
na str. 240 dopisać: Należy szczególnie przestrzec przed próbami wdychania podtlenku azotu N2O, czyli "gazu rozweselającego", sporządzonego w laboratorium. Po pierwsze, jest on z reguły zanieczyszczony innymi toksycznymi tlenkami azotu. Podtlenek azotu nie podtrzymuje oddychania, więc podczas narkozy podaje się go w mieszaninie z tlenem. Czysty podtlenek azotu może powodować tzw. "bezdech", czyli niebezpieczne zablokowanie akcji oddechowej!
na str. 243 dopisać kolejne ("korektorskie") Prawo Murphy'ego: W miarę przedłużania czasu korekty do nieskończoności, liczba błędów maleje do dwudziestu. (niniejsza errata może być potwierdzeniem słuszności tego prawa), oraz pozycje literaturowe: European Journal of Physics, 16, 172 (1995). Mathematics Today, 32 Nr 3-4, 39 (1996). Świat Nauki, kwiecień 1997, s. 56.
Tomasz Pluciński
nowy adres:
tomasz.plucinski@ug.edu.pl
| F | strona główna |