AKUMULATOR CYNKOWO-BROMOWY (kiepski, ale
pouczający...)
AKUMULATOR ENTROPOWY (i inne)
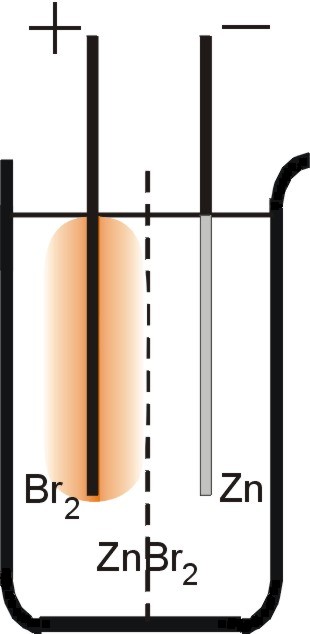
W zlewce umieścić ok. 10-procentowy roztwór ZnBr2. Można posłużyć się również mieszaniną KBr i ZnCl2 lub ZnSO4. Do zlewki zanurzyć dwie elektrody z węgla retortowego pochodzącego ze starej baterii. Przestrzeń pomiędzy elektrodami rozdzielić przez wstawienie do zlewki odpowiednio dopasowanej, podziurkowanej płytki z folii plastikowej. Do elektrod podłączyć źródło prądu stałego o napięciu kilku woltów. Zachodzącej elektrolizie towarzyszy osadzanie się srebrzystoszarej warstwy cynku na katodzie (–) oraz powstawanie żółtobrązowego zabarwienia roztworu otaczającego anodę (+).

| (–) (katoda): | Zn2+ + 2 e ® Zn | |
| (+) (anoda): | 2 Br– ® Br2 + 2 e |
Zn2+ + 2 Br– ® Zn + Br2 (sumarycznie)
Sumaryczna reakcja jest procesem niesamorzutnym i do jej wymuszenia niezbędne jest użycie energii elektrycznej dostarczonej z zewnątrz.
Po kilku minutach elektrolizy przewody zasilające odłączyć, a elektrody zewrzeć przewodem poprzez żaróweczkę, miniaturowy silniczek elektryczny, lub miliamperomierz.
Dotychczasowy elektrolizer zachowuje się teraz jak ogniwo i staje się źródłem energii. Podczas pracy ogniwa procesy zostają odwrócone:
| (–) (anoda): | Zn ® Zn2+ + 2 e | |
| (+) (katoda): | Br2 + 2 e ® 2 Br– |
Zn + Br2 ® Zn2+ + 2 Br– (sumarycznie)
W miarę pracy ogniwa obserwuje się stopniowe zanikanie srebrzystego osadu cynku oraz żółtego zabarwienia bromu Br2 . Sumarycznie proces polega więc tym razem na samorzutnej reakcji cynku z bromem, która jednak nie może zachodzić w sposób bezpośredni, ze względu na półprzepuszczalną przegrodę utrudniającą kontakt tych substancji. Reakcja zachodzi za pośrednictwem elektrod, “na raty”, a energię elektronów można dowolnie wykorzystać w miejscu odległym od zachodzącej reakcji. Taki skomplikowany sposób prowadzenia reakcji redoks "na raty", okazuje się jednak bardzo użyteczny w praktyce.
Siła elektromotoryczna SEM powstałego ogniwa zależy od stężenia wolnego bromu Br2 w pobliżu elektrody "+" # . W miarę przechowywania naładowanego akumulatora, brom dyfunduje w głąb roztworu i jego stężenie w pobliżu elektrody maleje. Przyczynia się to do stopniowego spadku SEM akumulatora. O wiele korzystniejsza dla zachowania stałości SEM akumulatora jest sytuacja, gdy wszystkie produkty utlenienia i redukcji są nierozpuszczalne i pozostają w kontakcie z elektrodami. W takiej sytuacji SEM pozostaje stałe nie tylko w trakcie przechowywania naładowanego akumulatora, ale również podczas jego pracy.
# Pojawia się problem nazewnictwa: elektroda ta podczas ładowania akumulatora była anodą, natomiast wytworzony brom Br2 będzie się podczas rozładowywania akumulatora redukował do anionów bromkowych; ta elektroda będzie więc katodą ! (anoda, to elektroda, na której zachodzi utlenianie, a katoda, to elektroda na której zachodzi redukcja. Czasami katodę definiuje się jako elektrodę, do której migrują kationy zarówno podczas elektrolizy, jak i pracy ogniwa. Tak bywa najczęściej, zdarza się jednak, że podczas elektrolizy, do anody zdążają kationy, i to przeciwko gradientowi pola elektrycznego!) Aby podczas ładowania aniony bromkowe zamienić w brom Br2, z elektrody trzeba "wypompować" elektrony przez dołączenie końcówki "+" zewnętrznego źródła prądu. Natomiast podczas rozładowywania akumulatora brom będzie pobierał elektrony z materiału elektrody, nadając jej również dodatni potencjał. Tak więc dana elektroda podczas ładowania i rozładowywania zmienia się z katody na anodę, natomiast "znak" elektrody pozostaje taki sam. Niektórzy nauczyciele mają zwyczaj zadawać uczniom kłopotliwe (i w gruncie rzeczy bezsensowne) pytanie: anoda, to "+", czy "-" ? Ten drobny problem przyczynia się do tego, że elektrochemia jest powszechnie nielubianym i niezrozumiałym działem chemii...
Gdyby przegrodę usunąć, dodatkowo ułatwiłoby to kontakt produktów wytworzonych podczas ładowania (elektrolizy) akumulatora. W trakcie przechowywania takiego naładowanego akumulatora bez przegrody, zachodziłaby dość szybka reakcja metalicznego cynku z bromem, identyczna jak podczas pobierania prądu podczas pracy akumulatora. Tym razem jednak reakcja ta zachodziłaby nie za pośrednictwem elektrod, lecz na drodze bezpośredniej syntezy. Energia procesu wydzielałaby się teraz w sposób ciągły, stopniowy i niekontrolowany jako ciepło, a więc w postaci najmniej użytecznej praktycznie. Niedopuszczenie do bezpośredniego kontaktu substancji aktywnych elektrochemicznie w akumulatorze jest więc decydujące dla jego wydajności energetycznej. Najtrudniej spełnić ten warunek, gdy choćby jeden z aktywnych produktów utlenienia lub redukcji jest rozpuszczalny. Najłatwiej zaś, gdy oba produkty są trudno rozpuszczalne. Powinny jednak one być przewodnikami prądu.
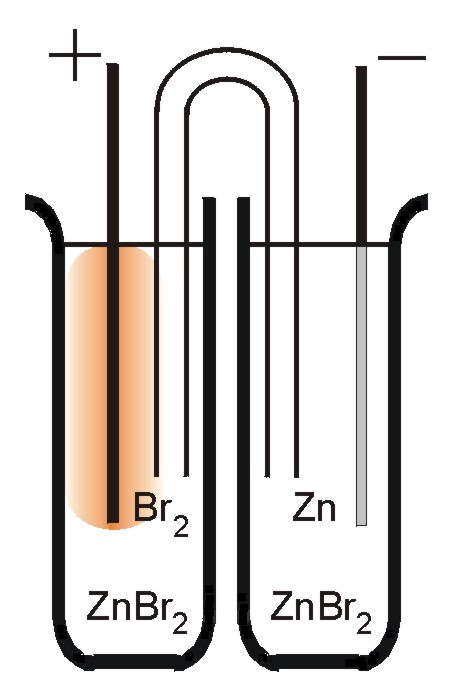
Części tych kłopotów można uniknąć, budując akumulator w postaci dwóch oddzielnych naczyń (półogniw), połączonych kluczem elektrolitycznym. Zapobiega się w ten sposób co prawda spadkowi stężenia produktu utlenienia, oraz zapobiega samorozładowaniu akumulatora, ale za to bardzo znacznie rośnie opór wewnętrzny urządzenia... Rola przepływu jonów w pracy ogniwa omówiona jest dokładniej w cytowanej literaturze.
Zapisywanie równania reakcji redoks w postaci sumy dwóch równań połówkowych redoks jest jednym ze sposobów bilansowania równań, często uważanego jedynie za procedurę mnemotechniczną. Warto pamiętać, że elektrolizer oraz ogniwo są tymi urządzeniami, w których procesy redoks biegną rzeczywiście w postaci oddzielnych, choć równoczesnych reakcji połówkowych rozdzielonych miejscami. Opis pracującego ogniwa wykorzystywany jest często przez dydaktyków do przystępnego wprowadzenia w termodynamikę reakcji chemicznych.
Opisany akumulator nigdy nie znalazł zastosowania praktycznego z powodu wskazanych mankamentów. Te właśnie wady są jednak doskonałą okazją dydaktyczną, aby wykazać trudności, na jakie napotyka się podczas opracowywania konstrukcji praktycznie działających takich urządzeń. Skonstruowanie sprawnego, lekkiego, taniego, trwałego, nie zanieczyszczającego środowiska trującym ołowiem, rtęcią lub kadmem akumulatora, jest poważnym wyzwaniem technologicznym, i to wręcz na miarę współczesnej cywilizacji. Pozwoliłoby bowiem na rozwiązanie (przynajmniej doraźnie) kłopotów związanych z zasilaniem pojazdów katastrofalnym wręcz zanieczyszczeniem spalinami przez tradycyjne silniki.
Doświadczenia z akumulatorem bromowo-cynkowym wygodniej jest prowadzić w U-rurce niż w zlewce; w tych warunkach znacznie łatwiej uniknąć mieszania się produktów elektrolizy. Jeżeli w dolnej części umieści się roztwór elektrolitu o znacznej lepkości i gęstości, to będzie on stanowił skuteczną przeszkodę przed mieszaniem, a dodatkowo umożliwi obserwację migracji jonów towarzyszącą elektrolizie.
AKUMULATOR TLENOWO-WODOROWY (ogniwo paliwowe)
U-rurkę napełnić do połowy wysokości kilkuprocentowym roztworem Na2SO4 lub H2SO4 i wstawić dwie elektrody grafitowe. Do elektrod podłączyć stałe napięcie kilku woltów i prowadzić elektrolizę przez kilkanaście sekund. Elektrody pokrywają się pęcherzykami gazów:
| (–) katoda: | 2 H2O + 2e ® H2 + 2 OH– | 1a | ||
| (+) anoda: | H2O ® 1/2 O2 + 2 H+ + 2e | 1b |
Po odłączeniu zasilania elektrody zewrzeć żaróweczką lub diodą świecącą LED. Należy robić to ostrożnie, aby nie usunąć pęcherzyków gazów z powierzchni elektrod. Podczas pobierania energii ogniwo tlenowo-wodorowe zachowuje się tak, jak paliwowe ogniwo tlenowo-wodorowe. Podczas pracy ogniwa poprzednie procesy zostają odwrócone:
| (–) anoda: | H2 + 2 OH– ® 2 H2O + 2e | 2a | ||
| (+) katoda : | 1/2 O2 + 2 H+ + 2e ® H2O | 2b |
Nie jest możliwe w praktyce zaobserwowanie wyraźnego zmniejszania się wielkości pęcherzyków gazów na elektrodach. Powodem jest zły kontakt gazów z materiałem elektrody i złe przewodnictwo elektryczne gazów. Jeśli jednak użyć elektrod platynowych zamiast grafitowych, to natężenie prądu jest wyraźnie większe, również SEM ogniwa jest wyraźnie większe. O zachodzeniu tych procesów elektrodowych świadczy więc pośrednio jedynie fakt przepływu prądu.
AKUMULATOR TLENOWO-WODOROWY BEZ TLENU I WODORU?
Dla wyjaśnienia opisywanych dalej procesów warto zadać sobie nieco więcej trudu przy przygotowywaniu elektrolizera. Sporządzić ok. 30 ml kilkunastoprocentowego roztworu Na2SO4 z dodatkiem zieleni bromokrezolowej, roztwór doprowadzić za pomocą dodatku bardzo rozcieńczonego H2SO4 lub NaOH do zielonej barwy przejściowej. W dolnej części umieścić roztwór Na2SO4, który nasycić zwykłym cukrem. Roztwór ten należy powoli wlać za pomocą pipety którą wprowadzić aż do dna U-rurki (na końcówkę pipety można wcześniej naciągnąć krótki kawałek miękkiego wężyka plastikowego). Dolną część U-rurki napełnić stężonym roztworem Na2SO4, a na tę warstwę nanieść w obu ramionach U-rurki ten sam roztwór Na2SO4, rozcieńczony jednak przez dodanie wody - w stosunku 1:1. Duża gęstość i lepkość roztworu w dolnej części naczynia zapobiega skutecznie mieszaniu poszczególnych warstw.
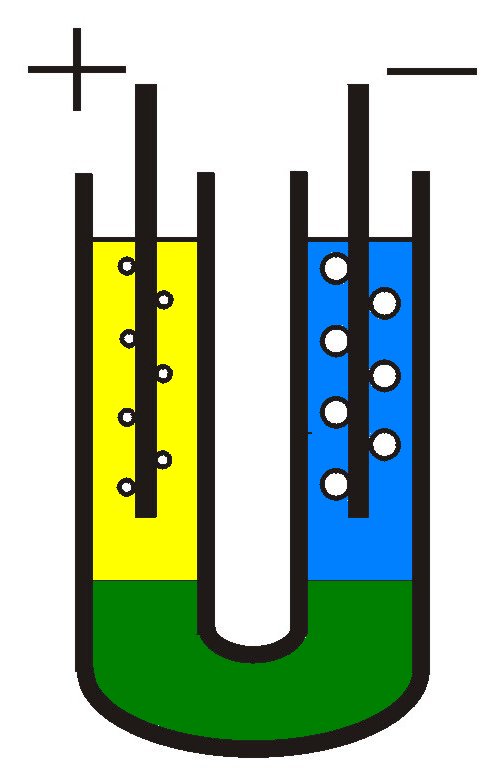
Po 2-3 minutach prowadzenia elektrolizy wyraźnie daje się zaobserwować zmianę barwy: w otoczeniu anody roztwór zostaje zakwaszony (® żółty), natomiast otoczenie katody zostaje zaalkalizowane (® niebieski); jest to zgodne z zapisem równań 1a i 1b.
Po odłączeniu zasilania elektrody wyjąć i zastąpić je nowymi elektrodami grafitowymi. Po ich zwarciu przez miliamperomierz, obserwuje się przepływ prądu. Dlaczego jednak ogniwo pracuje, skoro usunięto powstały tlen i wodór, stanowiące w poprzednim doświadczeniu źródło energii chemicznej (reakcja “spalania” wodoru)!?
| (–) anoda: | 2 OH– ® 1/2 O2 + H2O + 2e | 3a | ||
| (+) katoda : | 2 H+ + 2e ® H2 | 3b |
Podczas pracy akumulatora biegnie sumarycznie proces zobojętnienia kwasu i zasady powstałych wcześniej podczas ładowania akumulatora. Reakcja ta zachodzi nie bezpośrednio, ale za pośrednictwem elektrod. Reakcja zobojętnienia nie jest jednak procesem utlenienia-redukcji! Przy przepływie prądu elektrycznego przez granicę zetknięcia przewodnika elektronowego (materiał elektrody) oraz przewodnika jonowego (roztwór elektrolitu), musi zachodzić jakaś reakcja utlenienia-redukcji. Tylko bowiem w ten sposób przewodnictwo elektronowe może zostać zamienione na przewodnictwo jonowe... Znaczna część energii procesu zobojętnienia zostaje więc zużyta na niezbędną dla umożliwienia przepływu prądu reakcję redoks. Jest nią silnie endotermiczny proces rozkładu wody na tlen i wodór. Takie ogniwo daje więc bardzo niewiele użytecznej energii. Warto zauważyć, że gazy te powstają na przeciwnych elektrodach niż podczas procesu ładowania... Ilości wodoru i tlenu są bardzo niewielkie i nie da ich się zaobserwować w praktyce. O zachodzeniu tych procesów elektrodowych świadczy więc pośrednio jedynie fakt przepływu prądu.
AKUMULATOR "ENTROPOWY"
Proponuję Czytelnikowi wyjaśnienie następującego problemu doświadczalnego: jeśli w obu ramionach U-rurki umieścić roztwory H2SO4 o różnych stężeniach, to po wstawieniu elektrod grafitowych można z takiego (stężeniowego) ogniwa pobierać energię. Kosztem jakich procesów powstaje ta energia i jakie procesy elektrochemiczne temu towarzyszą?
Potencjał elektrody zanurzonej w roztworze o większym stężeniu kwasu, jest wyższy (z równania Nernsta wynika taka właśnie zależność od stężenia jonów H+, które są formą utlenioną układu redoks H+/H2). W wyniku pracy ogniwa stopniowo zmniejsza się kwasowość tego roztworu, jednak w tym samym czasie na drugiej elektrodzie, w roztworze bardziej rozcieńczonym, tworzą się kationy wodorowe. Pracy ogniwa towarzyszy więc wyrównywanie się stężeń oraz, ubocznie, powstawanie bardzo niewielkich ilości tlenu i wodoru na elektrodach. Zachodzenie procesu redoks jest niezbędne dla przepływu prądu. Skąd jednak bierze się energia na silnie endotermiczny proces rozkładu wody na pierwiastki oraz dodatkowo na ewentualne zasilanie odbiornika zewnętrznego? Jedynym źródłem jest sumaryczny proces wyrównania stężeń dwóch roztworów kwasu siarkowego. Jest to jednak proces fizyczny a nie chemiczny, którego energia jest bardzo niewielka. Również teraz nie da się więc zaobserwować powstawania gazów; wodór i tlen nie wydzielają się w postaci pęcherzyków, gdyż ogniwo stężeniowe daje SEM zbyt małe, aby przekroczyć nadnapięcie wydzielania wodoru i tlenu. Tworzą się tylko bardzo nieznaczne ilości wodoru i tlenu które zostają zaabsorbowane przez materiał elektrod (wodór jest doskonale rozpuszczalny w metalicznej platynie). O zachodzeniu tych procesów elektrodowych świadczy więc pośrednio jedynie fakt przepływu prądu.
Ogniwo to co prawda jest zupełnie nieprzydatne praktycznie, jest jednak ono interesującym przykładem zachodzenia F samorzutnej reakcji endotermicznej. Można nieco żartobliwie powiedzieć, że jest to akumulator napędzany czystą entropią...
ZNACZNIE LEPSZY AKUMULATOR ENTROPOWY
Poprzednie kłopoty doświadczalne spowodowane są przez małą odwracalność elektrochemiczną procesów elektrodowych (znaczne nadnapięcie) tworzenia wodoru i tlenu. O wiele łatwiej zmiany takie obserwować w przypadku bardziej odwracalnych procesów redoks.
U-rurkę napełnić ok. 10-procentowym roztworem CuSO4 i wstawić dwie elektrody miedziane. Akumulator ładować przez kilka godzin prądem o natężeniu kilkunastu mA.
Podczas elektrolizy stopniowo roztwór katodowy staje się jaśniejszy, natomiast barwa roztworu anodowego staje się coraz bardziej intensywna.
| (–) anoda: | Cu ® Cu2+ + 2e | (wzrost stężenia niebieskiej soli miedzi) | ||
| (+) katoda: | Cu2+ + 2e ® Cu | (spadek stężenia niebieskiej soli miedzi) |
Sumarycznie, zarówno podczas ładowania jaki i pracy ogniwa nie zachodzą żadne procesy chemiczne! Energia zewnętrzna zostaje zużyta jedynie na wymuszenie lokalnego spadku entropii wynikającego z wytworzenia gradientu stężeń CuSO4. Z tego ogniwa można czerpać znacznie większą moc - z powodu znacznie doskonalszej odwracalności procesów.
A CO Z ELEKTRONEUTRALNOŚCIĄ ?
W roztworze przykatodowym zmniejsza się ilość jonów Cu2+. Jeśli elektroliza jest dostatecznie intensywna, to szybkość dyfuzji jonów Cu2+ z głębi roztworu nie wystarcza do wyrównania tego ubytku. Co dzieje się w tym czasie z jonami SO42– ? Zasada elektroneutralności sprawia, że rozładowaniu jednego kationu Cu2+ towarzyszy migracja jednego anionu SO42– w głąb roztworu (tu: w kierunku dolnej części U-rurki). Ostatecznie: z roztworu katodowego są usuwane zarówno kationy jak i aniony, tworząc strefę rozcieńczenia stopniowo przesuwającą się w stronę anody.
W strefie anodowej powstaniu każdego kationu Cu2+ towarzyszy migracja jednego anionu SO42– ze strefy środkowej.
Można myślowo wyznaczyć pewien prostopadły przekrój U-rurki. Przez każdy taki przekrój przechodzi w ciągu sekundy tyle samo kationów miedzi, co anionów siarczanowych w przeciwnym kierunku. Jedynie w najbliższym sąsiedztwie katody z roztworu ubywają zarówno kationy jak i aniony. Powstaje strefa rozcieńczenia, która w miarę trwania elektrolizy przesuwa się w głąb roztworu. Podobnie ale odwrotnie jest w przestrzeni anodowej. W każdym przekroju zachowana jest zasada elektroneutralności.
Spadek stężenia roztworu przy katodzie powoduje dyfuzję elektrolitu w stronę katody. Można to zaobserwować, gdyż po dłuższej elektrolizie następuje wyraźne podwyższenie się granicy gęstego środkowego roztworu – w stronę katody, a jednocześnie obniżenie granicy strefy od strony anody. Migrują jedynie jony, natomiast pozbawione ładunku cząsteczki cukru pozostają w miejscu. Ruch naładowanych cząstek w polu elektrycznym (tutaj wspomagany na skutek zmian stężeń w wyniku elektrolizy) nazywa się elektroforezą. Czasami ruch odbywać może się w kierunku przeciwnym do gradientu pola elektrycznego: kationy mogą migrować w kierunku anody!
TO SAMO, ALE Z ELEKTRODAMI GRAFITOWYMI
Elektroliza roztworu CuSO4 z użyciem elektrod grafitowych (właściwie tylko jedna elektroda jest grafitowa; druga natychmiast pokrywa się metaliczną miedzią) nie jest oczywiście procesem tak doskonale odwracalnym elektrochemicznie, jak elektroliza na elektrodach miedzanych. Na katodzie podobnie jak poprzednio osadza się metaliczna miedź a w pobliżu elektrody powstaje strefa spadku stężenia roztworu.
Na anodzie zachodzi utlenianie wody (grafit jest dość odporny na utlenianie, podobnie nie jest zbyt łatwo utlenić jony siarczanowe do nadsiarczanowych)
| (+) anoda : | H2O ® 1/2 O2 + 2 H+ + 2e |
Tworzeniu dodatkowych kationów wodorowych na anodzie towarzyszy zgodnie z wymogiem elektroneutralności ruch (ujemnych) anionów siarczanowych w stronę anody. Jednocześnie kationy miedzi Cu2+ migrują powoli w stronę katody. Ten ruch spowodowany jest zarówno przez spadek stężenia kationów Cu2+ w pobliżu katody, jak i wskutek działania pola elektrycznego. Ostatecznie, roztwór CuSO4 w elektrolizerze stopniowo przekształca się w roztwór H2SO4. Sumarycznie:
CuSO4 + H2O ® Cu + 1/2 O2 + H2SO4
Zmiany te widoczne są najlepiej w otoczeniu anody: roztwór staje się wyraźnie kwaśny, co można łatwo sprawdzić za pomocą wskaźnika.
OGNIWO PRĄDU ZMIENNEGO (?!)
Praca ogniwa ma czasem charakter oscylacyjny. Odkrycie to było zresztą jednym z pierwszych doniesień o chemicznych reakcjach oscylacyjnych. Co prawda, okresowym zmianom ulega napięcie a nie kierunek prądu, ale zawsze jest zaskakujące, że ogniwa chemiczne wcale nie muszą być stabilnym źródłem elektryczności... (porównaj: ostatni link)
LITERATURA
T.Pluciński. "Doświadczenia chemiczne". Wyd. “Adamantan”, Warszawa 1997, s. 140. [Reakcja
redoks na sposób elektrochemiczny]
http://www.soeto.pl/ladowarki.html [Dane handlowe ładowarek do ogniw jednorazowych]
J.Chem.Educ., 78,
519 (2001) [Budowa ogniw jednorazowych]
J.Chem.Educ. 80, 1015 (2003) [Baterie litowe]
J.Chem.Educ. 79, 851 (2002) [Ogniwa długożyciowe]
J.Chem.Educ. 79, 334 (2002) [Akumulatory ołowiowe: teoria i
praktyka]
J.Chem.Educ. 76, 853 (1999), 77, 104
(2000), 78, 934 (2001). [błędy pojęciowe w zrozumieniu
elektrochemii]
http://www.uni-regensburg.de/Fakultaeten/nat_Fak_IV/Organische_Chemie/Didaktik/Keusch/cassy_pb_akku-e.htm akumulator ołowiowy
http://electrosource.com/batt_mnl/chap_1.htm charakterystyki akumulatorów ołowiowych
http://www.pacificsites.com/~brooke/batt.shtml Baterie, typy, porównanie, firmy
http://www.batterycanada.com/Battery_Facts.htm FAQ o bateriach
http://www.mywebplace.com/batterywholesale/batfaq1.html FAQ o bateriach
http://sciborg.uwaterloo.ca/~cchieh/cact/c120/battery.html chemizm baterii
http://www.howstuffworks.com/battery1.htm jak pracuje ogniwo (i inne mareiały dydaktyczne)
http://www.uni-regensburg.de/Fakultaeten/nat_Fak_IV/Organische_Chemie/Didaktik/Keusch/chembox_edison-e.htm akumulator Edisona
http://www.powerpulse.net/powerpulse/archive/aa_103000c1.stm przyszłość ogniw litowych
http://www.uni-regensburg.de/Fakultaeten/nat_Fak_IV/Organische_Chemie/Didaktik/Keusch/chembox_lecl-e.htm ogniwo "suche"
http://www.kkgwhv-schule.kwe.de/kkg_chem/ag_allg/aluminium/alframe.htm ogniwo z puszki aluminiowej
http://www.oeiizk.edu.pl/chemia/ogniwa/
praca przeglądowa o ogniwach
http://www.kkgwhv-schule.kwe.de/kkg_chem/ag_allg/mobile/mobframe.htm ogniwo prądu zmiennego
Skrzynia z nieczynnymi linkami (dwukrotnie w odstępie pół
roku nieczynne; będą za pół roku usunięte): L
http://www.accuoerlikon.com/html/accud02.htm akumulator ołowiowy
http://www.thiel.com/damien/newton_battery_FAQ.html Newton Battery FAQ
http://www.corrosion-doctors.org/Batteries/History.htm historia
http://www.hepi.com/basics/ wstęp do baterii
http://www.chemnet.nl/9250113/battery/battery.htm wszystko o
bateriach
http://www.windsun.com/batteries/battery_chemistry.htm "deep cycle"
http://www.greatbatch.com/WGL/electrochem.html ogniwa litowe
http://www.hdssystems.com/LithiumBattery.htm ogniwa litowe
http://www.hdssystems.com/Articles.htm artykuły o świetle i bateriach
http://www.transair.com/batteries.shtml technologia baterii miniaturowych
http://www.republika.pl/dj8051/teory_pliki/Ogniwa.htm
strona o ogniwach i akumulatorach
http://www.corrosion-doctors.org/Batteries/historyold.htm
"akumulator z Bagdadu"
Tomasz Pluciński
nowy adres:
tomasz.plucinski@ug.edu.pl
| F | strona główna |